Épidémie d’Enterococcus faecium résistant à la vancomycine (ERV) dans une unité de néphrologie.
Introduction
Les entérocoques sont des bactéries commensales du tractus gastro-intestinal chez les personnes saines. On les retrouve également au niveau de la partie avant de l’urètre, du vagin, de la peau et de l’oropharynx. Ce sont des pathogènes opportunistes humains. Il existe différentes espèces, mais ce sont surtout Enterococcus faecalis et Enterococcus faecium qui peuvent être à l’origine d’infections chez l’homme. Les infections graves les plus fréquentes provoquées par les entérocoques sont les bactériémies (parfois associées à des endocardites), les infections des voies urinaires, de plaies postopératoires, intra-abdominales et liées à un cathéter (1). Les patients à l’immunité affaiblie courent un risque accru. Il s’agit généralement de patients qui ont séjourné pendant un plus long moment à l’hôpital et qui ont reçu des antibiotiques (2). Depuis quelques décennies, on constate à l’échelle mondiale une résistance des entérocoques à la vancomycine. Les entérocoques résistants à la vancomycine (ERV) ne sont généralement pas plus pathogènes que les souches sensibles, même si leur profil de résistance complique le traitement d’infections à ERV. Ils ont également tendance à devenir endémiques, étant donné qu’ils survivent facilement dans l’environnement.
Lors du premier trimestre de 2015, le Centre de référence national (CRN) a reçu un nombre croissant d’isolats provenant de plusieurs hôpitaux, dont certains en situation d’épidémie (1). En octobre 2015, « l’Agentschap Zorg en Gezondheid » a émis un avis aux hôpitaux (VRE alert), les invitant à prêter attention à l’émergence d’ERV dans notre pays (4).
Jusqu’en 2011, les ERV étaient décelés de manière sporadique au sein de « l’Universitair Ziekenhuis Brussel » (UZ Brussel). Après un petit cluster en 2012, l’incidence est restée faible, avant de légèrement augmenter en 2015. En juin 2016, nous avons été soudainement confrontés à une hausse de la détection d’ERV dans l’unité de soins néphrologie et l’unité d’hémodialyse.
Nous allons dans cet article décrire le déroulement de l’épidémie et les mesures mises en place pour éviter toute nouvelle transmission.
Matériel et méthodes
Contexte
Lors de l’épidémie, l’unité de soins néphrologie se composait de 29 lits, répartis entre 9 chambres privées avec coin sanitaire individuel et 10 chambres à deux personnes avec sanitaires communs. Cette unité accueille des patients souffrant de problèmes médicaux ou chirurgicaux au niveau des reins et voies urinaires, comme par exemple des patients sous dialyse et ayant subi une transplantation rénale, des patients souffrant d’infections des voies urinaires ou autres organes internes.
L’unité d’hémodialyse traite aussi bien des patients ambulants que des patients hospitalisés. L’unité se compose de 5 salles réparties sur 2 étages. Au total, 70 patients peuvent être traités par jour à l’UZ Brussel, 6 jours sur 7. Des patients sont également dialysés dans 2 unités sur des sites extérieurs à l’hôpital.
L’épidémie a été décelée au sein de l’unité néphrologie auprès de patients qui étaient également traités par hémodialyse à l’UZ Brussel. Au moment de l’épidémie, 26 patients étaient en moyenne hospitalisés à court et long termes dans l’unité.
Microbiologie
Des prélèvements rectaux (eSwab, Copan, Brescia, Italie) de patients ont été ensemencés sur un milieu de culture chromogène, sélectif (ChromID VRE, bioMérieux, Marcy l’Etoile, France). Les boites ont été examinées après 24 et 48 heures d’incubation à 35°C pour identifier la présence d’ERV. Les entérocoques présentant une résistance intrinsèque à la vancomycine (E. gallinarum et E. cassiflavus) ne se développent, dans des circonstances normales, pas sur ces boites. Les colonies suspectes ont une couleur bleu-rose. Ces colonies ont été sélectionnées pour identification ultérieure par le biais d’un spectromètre de masse couplant une source d’ionisation laser assistée par une matrice et un analyseur à temps de vol (MALDI-TOF MS) avec l’aide d’un spectromètre de masse Microflex LT équipé du logiciel MALDI Biotyper 3.0 et de la bibliothèque de référence Library 3.2.1.0 (Bruker Daltonik GmbH, Brême, Allemagne). Dans le cas de la présence d’entérocoques, une PCR multiplex a été réalisée pour détecter la présence de gènes van (vanA, vanB (B-1, B-2 de B-3), vanC-1 et vanC-2/C-3).
Un ERV est défini comme souche Enterococcus faecium avec des CMI de la vancomycine > 4mg/l par l’acquisition d’un gène vanA- ou vanB-. (HGR 9277)
Tous les isolats ont été envoyés au laboratoire de référence pour typage ultérieur. Un typage par séquençage multilocus (MLST) a été réalisé sur toutes les souches. L’électrophorèse en champ pulsé (ECP) n’a été réalisée que sur une partie des souches.
Évolution de l’épidémie et mesures adoptées
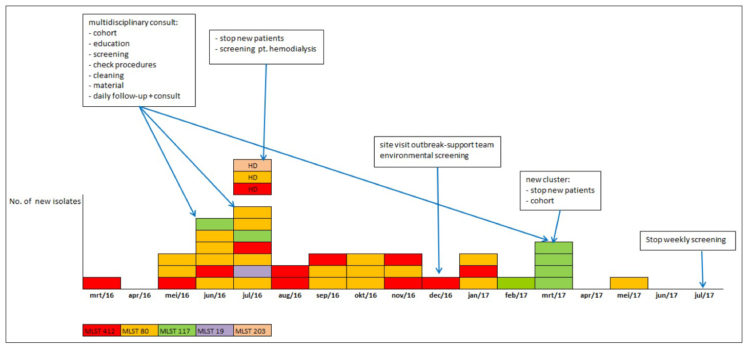
Entre juin 2016 et juin 2017, l’unité néphrologie a accueilli 37 patients porteurs d’ERV vanA probablement d’origine nosocomiale, dont 4 dans des échantillons cliniques et 33 dans prélèvements rectaux.
À l’automne 2016, le nombre de nouveaux patients porteurs d’ERV dans l’unité de néphrologie a augmenté d’un cas en mars à six cas en mai et juin (dont 3 avec prélèvements rectaux positifs et 4 avec échantillons cliniques positifs). Trois des patients porteurs d’ERV avaient été traités dans l’unité d’hémodialyse. Pour empêcher la propagation, en marge des précautions, des actions supplémentaires ont été entreprises au sein de l’unité d’hémodialyse et de l’unité néphrologie. Les précautions et actions supplémentaires sont décrites ci-après (3-4-5-6-7).
Une équipe multidisciplinaire pour la gestion de l’épidémie a été constituée. Elle se composait de membres de l’équipe d’hygiène et s’est réunie la première fois le 29 juin 2016. Tous les patients présents dans l’unité de soins néphrologie ont fait l’objet d’un dépistage immédiat qui a ensuite été répété sur une base hebdomadaire. Tous les patients hémodialysés (N=100) ont été dépistés une seule fois. Ce dépistage a permis de déceler trois patients porteurs d’ERV supplémentaires.
Pour prévenir la transmission, les patients porteurs d’ERV ont été cohortés avec des prestataires de soins leur ayant été spécifiquement attribués, tant au sein de l’unité de soins qu’au sein de l’unité d’hémodialyse. Un nettoyage et une désinfection poussés du matériel et des chambres ont été soulignés par une extension du matériel lié au patient et une attention spéciale a été accordée aux surfaces « à contact élevé » et aux sanitaires. Certaines procédures n’ont pas été assez respectées et quelques zones grises sont apparues, comme le nettoyage et la désinfection de la chaise balance entre 2 patients. Une (re)formation et un suivi continu du personnel et des patients ont été organisés.
Étant donné que, en dépit de ces précautions, l’incidence a continué d’augmenter, plus aucun patient n’a été accepté pendant trois semaines à l’unité néphrologie, sauf s’il était porteur d’ERV connu. Les nouveaux patients étaient admis dans une autre unité. Les patients dialysés hospitalisés porteurs d’ERV ont été, pendant leur dialyse, regroupés en cohorte dans une seule salle de dialyse. Cette salle a une capacité de 5 lits, avec un box d’isolement supplémentaire (1 lit). Ce box d’isolement est réservé aux patients en isolement de contact avec des micro-organismes multirésistants ou diarrhée Clostridium difficile. L’accès à ce box d’isolement se fait par le biais d’un sas où les éléments nécessaires à une bonne hygiène des mains sont présents, comme un lavabo, du savon, des serviettes en papier jetables et une solution hydroalcoolique. En entrant dans ce sas, un tablier jetable était toujours enfilé.
Plusieurs des porteurs d’ERV hospitalisés étaient des patients ayant subi une transplantation rénale. Après leur sortie de l’hôpital, ils ont été suivis en consultation polyclinique. L’application de précautions supplémentaires pour ces porteurs d’ERV a été compliquée par l’absence d’une signalisation claire (BVM) dans le dossier patient électronique pour patients ambulants et par le fait qu’à la consultation, aucun sanitaire distinct n’est disponible. Aucune séparation entre espace d’examen, matériel médical ou salle d’attente n’était également présente. Pour limiter la transmission, il a été fait appel à une éducation des patients par le biais d’une formation orale répétée et de brochures d’information écrites. Un document a été établi pour informer correctement les médecins généralistes des patients concernés à propos de la politique appliquée avec les porteurs d’ERV.
L’équipe d’hygiène hospitalière était quotidiennement présente dans l’unité de soins et d’hémodialyse pour veiller à la bonne application des précautions et continuellement procéder à des adaptations lorsque nécessaire.
L’Outbreaksupport team (OST) du gouvernement fédéral a également été consultée (délégués de l’Agentschap Zorg en Gezondheid, délégués de l’ancien ISP (Sciensano) et des experts du Centre de référence national). Ils ont participé à différentes réunions, ont organisé une visite non annoncée aux unités, ont observé et prélevé des échantillons des surfaces et des mains des prestataires de soins. Aucun ERV n’a été décelé. Certains échantillons présentaient toutefois un nombre élevé de germes.
Après une diminution de l’incidence, un nouveau cluster a été identifié en mars 2017 et il a à nouveau été procédé au regroupement en cohorte des patients et du personnel. Le nettoyage a été contrôlé à l’aide d’échantillons bactériologiques, mais aucun ERV n’a été décelé.
En juin 2017, le dépistage hebdomadaire des patients hospitalisés a pris fin, 4 semaines après la dernière détection d’un nouveau porteur dans l’unité. Tous les nouveaux patients hémodialysés sont toujours dépistés. Les patients qui reviennent de vacances et qui ont été temporairement dialysés dans un autre centre sont également soumis à un dépistage.
Les porteurs d’ERV sont suivis de près. Les précautions supplémentaires ont été interrompues après 3 dépistages négatifs à un intervalle d’un mois.
Résultats microbiologiques
MLST et PGFE ont indiqué une épidémie polyclonale. 5 types MLS différents ont été décelés : MLST 19 (N=1), MLST 80 (N=19 ; dont 16 typés avec PFGE, démontrant 7 pulsotypes différents), MLST 117 (N=7 ; typage de 2 souches avec PFGE a démontré différents pulsotypes), MLST 203 (N=1) et MLST 412 (N=12; typage de 8 isolats a démontré 3 pulsotypes différents). MLST 412 apparaît seulement à l’UZ Brussel, tandis que les autres types de MLST se retrouvent également dans d’autres établissements de soins de santé.
Figure 1 : Évolution épidémique
Discussion/conclusion
Cette épidémie a été détectée grâce à une incidence accrue d’ERV dans des échantillons cliniques. Grâce notamment à l’extension de la politique de dépistage entre juin 2016 et juin 2017, 37 patients porteurs d’ERV vanA ont été détectés. Dans 89 % des cas, l’ERV a uniquement été décelé dans les échantillons de dépistage. Les analyses microbiologiques ont indiqué une épidémie polyclonale. Des récentes études ont démontré qu’en marge de la transmission clonale, le gène vanA était également capable de se transmettre par transfert horizontal à des populations multiples d’Enterococcus faecium sur des éléments mobiles comme les transposons et plasmides (8-9).
Une vigilance accrue, une meilleure hygiène des mains et un meilleur entretien du matériel commun auront permis de maîtriser cette épidémie. L’arrêt du dépistage hebdomadaire peut induire une sous-estimation de l’incidence actuelle d’ERV.
L’épidémie et les mesures introduites ont eu un impact notable sur les patients et les prestataires de soins : charge de travail, isolement de patients, report d’examens à la fin de la journée, prix du matériel lié au patient, cessation temporaire de l’admission, donnant lieu à des admissions dans d’autres services, etc…
Les porteurs connus ont été suivis et des précautions additionnelles appliquées en cas d’hospitalisation ou de séances de dialyse. Les précautions additionnelles n’ont été interrompues qu’après 3 dépistages négatifs à un intervalle de chaque fois un mois.
Toutes les recommandations de l’OST n’ont pas pu être réalisées. Dans sa configuration actuelle, l’unité d’hémodialyse ne dispose pas d’une toilette distincte pour les patients faisant l’objet de précautions additionnelles. Mais reste à voir si une toilette de ce type apporterait une plus-value, étant donné qu’il s’agit de patients ambulants qui utilisent également les autres toilettes publiques de l’hôpital et sont transportés dans le même taxi. Vu que le gros de ces patients sont présents de manière ambulante dans l’hôpital, il a surtout été misé sur l’éducation des patients et le respect d’une hygiène des mains poussée dans les services de consultation et médico-techniques.
Les patients néphrologiques font partie du groupe à risque pour l’acquisition de micro-organismes multirésistants, une vigilance continue étant dès lors de mise pour éviter les clusters.
Bibliographie
1.https://www.gezondheid.nl/medische-dossiers-aandoeningen/enterococcus-faecium, geraadpleegd op 01/06/2016
2. Enterococcal Infections, Vancomycin Resistant» (PDF). Infectious Disease Epidemiology Section Office of Public Health, Louisiana Dept of Health & Hospitals. 8 September 2008)
3. https://www.gezondheidsnet.nl/bacterien/hoe-gevaarlijk-is-de-vre-bacterie geraadpleegd op 15/07/2016
4. Agentschap zorg en gezondheid, Wetenschappelijk Instituut Volksgezondheid. Toename van het aantal uitbraken met vancomycine resistente enterokokken (VRE) in ziekenhuizen in België. VRE alert oktober 2015/21.10.2015.
5. Jansens H. et al, Succesful control of vancomycine-resistant enterococci outbreak in a hematology unit. Antimicrobial Resistance and Infection Control, 2015, 4, p.199
6. Fournier S. et al, Long-term control of vancomycin-resistant Enterococcus faecium at the scale of a large multihospital institution: a seven-year experience, Surveillance and outbreak reports, 26/07/2012
7. Katrine Gram Landerslev et al., Polyclonal spread of vanA Enterococcus faecium in Central Denmark Region, 2009–2013, investigated using PFGE, MLST and WGS, International Journal of Antimicrobial Agents (2016), doi: 10.1016/j.ijantimicag.2016.09.001
8. Pinholt Mette et al, Genomic analysis of 495 vancomycin-resistant Enterococcus faecium reveals broad dissemination of a vanA plasmid in more than 19 clones from Copenhagen, Denmark. Journal of antimicrobial chemotherapy September 7, 2016.
9. Bodrick Hayley et al, Whole-genome sequencing reveals transmission of vancomycin-resistant Enterococcus faecium in a healthcare network. Genome Medicine (2016)8:4.
Nouveautés
Agenda scientifique
- mars 2024
-
28/03
Symposium BICS
- avril 2024
-
du 8/04 au 11/04 || à Edinburgh
The Microbiology Society Annual Conference
-
du 23/04 au 24/04 || à Birmingham
Prévention et Contrôle des infections (IPC)
-
du 27/04 au 30/04 || à Barcelone
34th European Congress of Clinical Microbiology and infectious diseases
- mai 2024
-
du 16/05 au 17/05 || à Louvain-La-Neuve
18ème Rencontre Internationale Francophone des Infirmiers et Infirmières (RIF)