Sanitaire installaties en afvalwaterleidingen als bron voor de langdurige verspreiding van carbapenemase producerende Citrobacter freundii in een ziekenhuisomgeving
Dit artikel is een herwerking van een eerder gepubliceerd manuscript in Antimicrobial Resistance & Infection Control (BioMed Central), zie referentie [1]. Lijst van originele auteurs; Hannelore Hamerlinck, Annelies Aerssens, Jerina Boelens, Andrea Dehaene, Michael McMahon, Anne-Sophie Messiaen, Stien Vandendriesssche, Anja Velghe, Isabel Leroux-Roels, Bruno Verhasselt.

Introductie
Carbapenemase Producerende Enterobacteriën (CPE) werden door de Wereldgezondheidsorganisatie geclassificeerd als een prioriteit 1 (kritieke) ziekteverwekker in de ranglijst van antibioticaresistente bacteriën [2]. Kolonisatie met CPE wordt geassocieerd met een kans van 16,5% op infectie, een kans die aanzienlijk stijgt bij oudere en immuungecompromitteerde patiënten [3, 4]. Aangezien CPE meestal multiresistent zijn, zijn infecties vaak moeilijk te behandelen omdat slechts weinig antibiotica-opties beschikbaar zijn. De klinische uitkomst bij patiënten is daarom slecht en de algehele morbiditeit, verblijfsduur en mortaliteit zijn verhoogd in vergelijking met gevallen van infectie met niet-carbapenemase-producerende Enterobacterales [4].
Citrobacter freundii is een facultatieve anaerobe Gram-negatieve staaf die voorkomt in bodem, water, voedsel en darmen. Het wordt vaak beschouwd als een onschadelijke contaminant of kolonisator. Citrobacter spp. infectie kan echter zeer ernstig zijn en moeilijk te behandelen, vooral bij pasgeborenen, oudere volwassenen en immuungecompromitteerde patiënten [5]. Er is steeds meer bewijs dat Citrobacter freundii een groeiende rol speelt in CPE-uitbraken in zorginstellingen [6, 7].
Kolonisatie van CPE bij patiënten komt meestal voor in het maagdarmkanaal, waardoor aanwezigheid in ziekenhuisafvalwater kan worden verwacht. Ziekenhuis sanitaire voorzieningen, zoals wastafels, toiletten en douches, worden erkend als reservoirs voor CPE [7, 8]. De waterrijke omgeving creëert gunstige omstandigheden voor microbiële kolonisatie. Daarnaast is in verschillende zorginstellingen aangetoond dat toiletwater fungeert als een geschikt reservoir voor CPE transmissie, dit ook in de brandwondeneenheid van onze eigen instelling [9].
Afvalwaterleidingen worden verondersteld een mogelijke route van verspreiding te zijn. Echter is er weinig bekend over het belang van afvalwaterleidingen als verspreidingsroute in een ziekenhuisomgeving. In ons onderzoek werden klinische en omgevings-isolaten van CPE C. freundii, verzameld tussen 2015 en 2022, onderzocht op klonale verwantschap met behulp van whole genome sequencing (WGS) en daaropvolgende core genome multilocus sequence typing (cgMLST) analyse. Door de rol van sanitaire installaties in patiënten-badkamers en het afvalwater afvoersysteem als reservoirs en transmissieroutes te onderzoeken, streven we naar meer begrip van transmissieroutes en naar invoeren van gerichte preventieve maatregelen.
Methode
Na het vaststellen van een onverwacht hoge frequentie van Carbapenemase-producerende Citrobacter freundii bij patiënten op de geriatrische afdeling van het UZ Gent, is er een retrospectieve moleculaire analyse uitgevoerd op bacteriële isolaten van patiënten (30) en omgevingsstalen (23) om meer diepgaand inzicht te verkrijgen. De staalafnames vonden plaats tussen 2015 en 2022.
De conventionele analyses omvatten het identificeren van bacteriën met MALDI-TOF MS en het detecteren van carbapenemase met PCR [9]. Daarna werd bij geselecteerde isolaten DNA-extractie uitgevoerd, gevolgd door shotgun whole genome sequencing met behulp van Illumina-sequencing (HiSeq 3000 / NovaSeq 6000). De bekomen data werden geanalyseerd aan de hand van Core genome MLST analyse (cgMLST) waarbij kan worden bepaald of isolaten gerelateerd zijn aan elkaar (minder dan 20 allelen verschil) of niet (meer dan 40 allelen verschil).
De onderzochte geriatrische afdeling bestaat uit 17 patiëntenkamers aan dezelfde zijde van de gang, elke kamer heeft een kleine badkamer. Grijs (wastafel/douche) en bruin (toilet) water worden via verschillende naastgelegen leidingen getransporteerd in 2 circuits (kamer R1-R9 en kamer R10-R16). Bij opname op de geriatrische afdeling werden alle patiënten standaard gescreend op CPE met een rectaal uitstrijkje. Bij een positieve CPE-test tijdens de ziekenhuisopname volgde wekelijkse screening van alle andere patiënten. CPE-positieve patiënten werden in isolatie gehouden, met strenge reinigingsprocedures na ontslag. Dagelijks werden alle kamers gepoetst.
Resultaten
CPE detectie
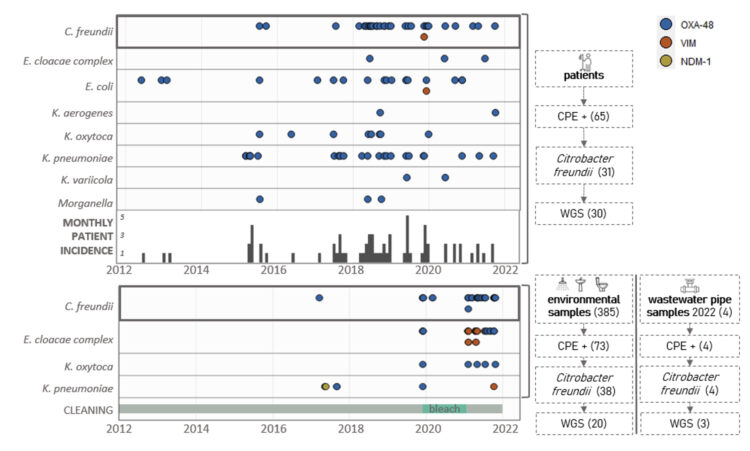
Gedurende een decennium (2012-2021) zijn één of meerdere CPE-soorten geïsoleerd bij 65 individuele patiënten op de geriatrische afdeling van het UZ Gent, waarbij 14 patiënten een infectie ontwikkelden. Het overgrote deel van de gevallen was nosocomiaal (92,3%), en bij bijna de helft van de patiënten werd Citrobacter freundii gedetecteerd (47,7%), zoals weergegeven in Figuur 1. Andere veelvoorkomende soorten waren K. pneumoniae (38,4%) en E. coli (29,2%).
Het onderzoek van de omgeving concentreerde zich op toiletwater, doucheafvoeren en wastafelafvoeren, waarbij positieve omgevingen regelmatig werden gevolgd. Daarnaast zijn ook de verzamelleidingen van het afvalwater (grijs en bruin) onderzocht. In totaal testten 77 van de 389 omgevingsmonsters positief voor één of meer carbapenemasen, zoals geïllustreerd in Figuur 1. De hoogste detectiepercentages werden vastgesteld in de doucheafvoeren (38,2%) en toiletwatermonsters (25,0%). De CPE-positiviteitspercentages in monsters van wastafelafvoeren waren tien keer lager (3,3%). Citrobacter freundii was de meest voorkomende soort (52,1%), gevolgd door het Enterobacter cloacae complex (41,1%), Klebsiella pneumoniae (9,6%) en Klebsiella oxytoca (6,8%).
Cluster-analyse
Om de klonale verwantschap tussen patiënten- en omgevingsisolaten te onderzoeken, werd ‘whole genome sequencing’ (WGS) uitgevoerd uit op 53 Citrobacter freundii-isolaten. Clustering, gebaseerd op de ‘minimum spanning tree’ gecreëerd na cgMLST-analyse, toonde 12 gevallen waarin géén klonale relatie kon worden gevonden: «sporadisch», zie Figuur 2&3. De overige 41 isolaten werden ingedeeld in 5 verschillende clusters: Cluster A-E.
ClusterB (ST170) omvat 12 isolaten waarvan er 9 nauw verwant zijn en 4 meer afgelegen. Alle monsters, behalve één, werden afgenomen in dezelfde kamer: R06, zie Figuur 3. Het eerste isolaat was afkomstig van een patiënt in 2015 en het laatste van een monster van de afvoerleiding van bruin water afgevoerd van kamers R01-R09 afgenomen in 2022. In totaal werden 8 patiënten, gecategoriseerd als nosocomiaal, verbonden met deze cluster. Een periode van 3 jaar scheidt de tweede (2015) en derde (2018) patiënt. De terugkeer van de kloon in 2018 kon niet worden verklaard door herintroductie door een eerdere bewoner. In 2017 werd echter dezelfde ClusterB-kloon gedetecteerd in het toiletwater van kamer R06. Een geassocieerde kloon werd opnieuw gevonden in het toiletwater in 2019 en in 2021, wat wijst op de vermoedelijke aanwezigheid van een reservoir in het toilet. Een vergelijkbare situatie werd opgemerkt in ClusterC (ST421). Deze cluster bestaat uit 2 patiënten-isolaten en 1 toilet-isolaat, allen afgenomen in dezelfde kamer: R02. De monsters werden meer dan een jaar na elkaar verzameld (2018, 2019 en 2021).
ClusterA (ST22) telt 21 isolaten, waarvan er 12 afkomstig zijn van patiënten die tussen 2018 en 2021 zijn bemonsterd. In de loop van de onderzochte tijd lijkt de cluster geleidelijk door de gang te verschuiven, beginnend bij de kamers in de tweede helft van de gang en zich uitstrekkend tot de kamers aan het begin, zoals te zien in figuur 3. De meeste patiëntgevallen waren enkele maanden van elkaar gescheiden; daarom werd vermoed dat er een reservoir in de omgeving aanwezig was. Isolaten uit 6 toiletmonsters en 2 doucheafvoeren werden geclassificeerd tot dezelfde cluster. In kamer R04 kon de aanwezigheid van Citrobacter freundii ClusterA reeds weken vóór de diagnose van de eerste ClusterA-patiënt in deze kamer bevestigd worden. Uiteindelijk (2022) werd ClusterA ook gedetecteerd in de afvoerleiding die het grijze water van kamers R01-R09 afvoert.
Discussie
Waterreservoirs
Waterreservoirs spelen een cruciale rol in de overdracht van CPE, dit werd reeds meermaals beschreven voor wastafels [3]. In onze studie bleken monsters van toiletwater en doucheafvoer vaker positief voor CPE dan de afvoerputjes van wastafels. De cgMLST-analyse toonde twee clusters die exclusief voorkwamen in specifieke kamers. Deze clusters werden ook aangetroffen in het toiletwater van de betreffende kamers. Hoewel het moeilijk te bewijzen is of het toilet fungeert als ontvanger dan wel als verspreider [10], wordt hier toch een verspreidende rol vermoed, gezien de clusters gedurende meerdere jaren detecteerbaar waren, zelfs op momenten dat er geen CPE-positieve patiënt in de kamer was. De overdracht zou kunnen worden veroorzaakt door de vorming van druppels of bioaerosol, zoals ook is beschreven bij andere CPE-uitbraken [8, 9]. Door toiletspoeling en daaropvolgende vorming van bioaerosol kunnen (pathogene) bacteriën zich verspreiden in het gebied (> 0,5 m) en langdurig in de lucht blijven (> 15 min), wat kan leiden tot overdracht via huidcontact, oppervlaktebesmetting of inademing [11]. Bovendien kan overdracht plaatsvinden via de verspreiding van druppels tijdens het doorspoelen van het toilet en het plassen [12]. Deze hypothese van sanitaire voorzieningen die een belangrijke rol spelen bij het in stand houden van een reservoir voor multidrugresistente organismen wordt steeds vaker gepostuleerd, vooral op afdelingen met een hoge blootstelling aan antibiotica [13].
Migratie via biofilm
De grootste cluster van CPE-positieve Citrobacter freundii verspreidde zich over de gehele afdeling. Een aanzienlijk deel van de overdrachten kon niet worden verklaard door patiënt-tot-patiënt-overdracht vanwege lange intervallen tussen opnames, vaak van enkele maanden. Eerder onderzoek in het UZ Gent onthulde de afvoerleidingen als een mogelijke route voor CPE-kruisbesmetting tussen kamers via de retrograde migratie van biofilms [9]. We veronderstellen een vergelijkbaar mechanisme voor de verspreiding van deze grote cluster. We gaan ervan uit dat de interne overdracht via de retrograde vorming van biofilm in de afvoerleidingen zich minstens in 3 situaties heeft voorgedaan. Bovendien wordt deze hypothese ondersteund door de detectie van de cluster in de afvoerpijp van het grijze water op enkele meters afstand, meer dan een jaar na de detectie van de laatste patiënt in de cluster. Onderzoek met Escherichia coli-stammen heeft aangetoond dat verspreiding via biofilm van afvoerleidingen naar afvoerputjes in een ziekenhuisomgeving kan plaatsvinden met een snelheid van ongeveer 2,5 cm per dag [14]. Theoretisch gezien zou een afstand van enkele meter in minder dan 6 maanden kunnen worden overbrugd, wat realistisch lijkt gezien het tijdsbestek van gebeurtenissen in onze studie. Voor zover wij weten, is een CPE-biofilmverspreiding van meerdere meters via afvoerleidingen nog niet beschreven.
Elimineren van de reservoirs
In 2020 was er duidelijk sprake van minder CPE-patiëntgevallen. Dit zou mogelijk kunnen worden toegeschreven aan een grotere naleving van handhygiëne en schoonmaakprotocollen tijdens de SARS-CoV-2-pandemie. Een andere bijdragende factor zou de dagelijkse desinfectie van toiletten met een verdunde bleekwater-oplossing van december 2019 tot januari 2021 kunnen zijn. Hoewel regelmatige reiniging met bleekmiddel of azijnzuur tijdelijk resistente micro-organismen kan verminderen, wordt het vervangen van verontreinigde reservoirs vaak als de meest effectieve methode beschouwd. Echter, het vervangen van sanitaire installaties garandeert geen succes vanwege het risico op herkolonisatie door patiënten of retrograde migratie van biofilms in het rioolsysteem. Een experiment met een nieuw toilet in één kamer toonde herkolonisatie binnen twee weken aan. Volledige verwijdering van wastafels en waterloze patiëntenzorg is gunstig gebleken in sommige omgevingen, maar deze maatregelen zijn uitdagend in reguliere ziekenhuisafdelingen [15]. Een gerandomiseerde gecontroleerde studie suggereert dat een combinatie van chemische, mechanische en thermische reiniging tot aan het P-sifon-niveau de beste korte-termijn desinfectie biedt voor afvoerputjes van wastafels en douches, maar implementatie van deze methoden in P-sifons van douches en toiletten is niet evident [16].
Verminderen van de blootstelling
Wassen zonder water, door het gebruik van reinigingsdoekjes, is standaard geïmplementeerd op de afdeling. Opmerkelijk is dat de douches al zelden werden gebruikt door de geriatrische populatie. Daarnaast werden tijdens de eerste maanden van de pandemie (mei 2020) gedrukte stickers met de tekst «Sluit het toiletdeksel bij het doorspoelen» op alle toiletten geplaatst om de verspreiding van micro-organismen naar omringende oppervlakken te verminderen. Het is echter onduidelijk in hoeverre deze instructie werd opgevolgd. Ziekenhuisbadkamers zijn vaak klein met de wastafels, het toilet en de douche dicht bij elkaar. Dit kan leiden tot kruisbesmetting van sanitaire installaties via bioaerosols. Daarom worden toiletten het best geïnstalleerd in een aparte ruimte, of alternatief kunnen spatschermen een fysieke barrière bieden. Een nieuwe techniek om bioaerosol- en druppelverspreiding van water in de toiletpot te verminderen, is het creëren van een schuimlaag, zoals beschreven door Arena et al. [12]. Om het probleem van biofilm-verspreiding aan te pakken, is het ontwerp en onderhoud van het ziekenhuisleidingwerk van cruciaal belang. Biofilm-vorming wordt bevorderd door stilstaand water, pijpcorrosie, warme kamertemperaturen en beschikbare voedingsstoffen. Het leidingsysteem en het gebruik van sanitaire voorzieningen moeten daarom worden beoordeeld en verbeterd waar mogelijk, mogelijk met behulp van richtlijnen zoals die van de Centers for Disease Control and Prevention (CDC). Ten slotte wordt het gedrag van zorgverleners ook beschouwd als een cruciale factor, wat naleving van richtlijnen voor handhygiëne en correct gebruik van sanitaire voorzieningen omvat.
Conclusie
Deze retrospectieve studie wijst sterk op de betrokkenheid van sanitaire voorzieningen en afvoerleidingen bij de verspreiding en transmissie van CPE in een ziekenhuisomgeving. Met behulp van cgMLST werd klonaliteit aangetoond in vijf clusters van CPE Citrobacter freundii. Drie clusters omvatten zowel patiënt-isolaten als isolaten uit toiletwater en doucheafvoeren. Indirecte transmissie lijkt plaats te vinden via de vorming van bioaerosols en druppels tijdens het spoelen, urineren of douchen. In meer dan een derde van de kamers op de geriatrische afdeling was het toiletwater of de douchegoot gekoloniseerd met dezelfde Citrobacter freundii cluster. Ondanks contactisolatiemaatregelen en reinigings- en desinfectieprocedures lijkt de verspreiding zich geleidelijk over meerdere jaren te hebben voorgedaan. Bovendien werden isolaten van dezelfde stam gedetecteerd in de afvoerleiding van het afvalwater. Daarom suggereren we dat interne verspreiding plaatsvond via het afvoersysteem door retrograde vorming van biofilms. Een multidisciplinaire aanpak is nodig om dit complexe probleem aan te pakken, inclusief het verbeteren van het gebruik, de reiniging, het ontwerp en het onderhoud van sanitair en leidingen binnen zorginstellingen.
Figuur 1: Visualisatie van carbapenemase-producerende Enterobacterales (CPE) per species in de loop van de tijd in patiënt- en omgevingsstalen op de geriatrische afdeling van UZ Gent [1].
Figuur 2: Clusteranalyse van 53 Citrobacter freundii-isolaten [1].
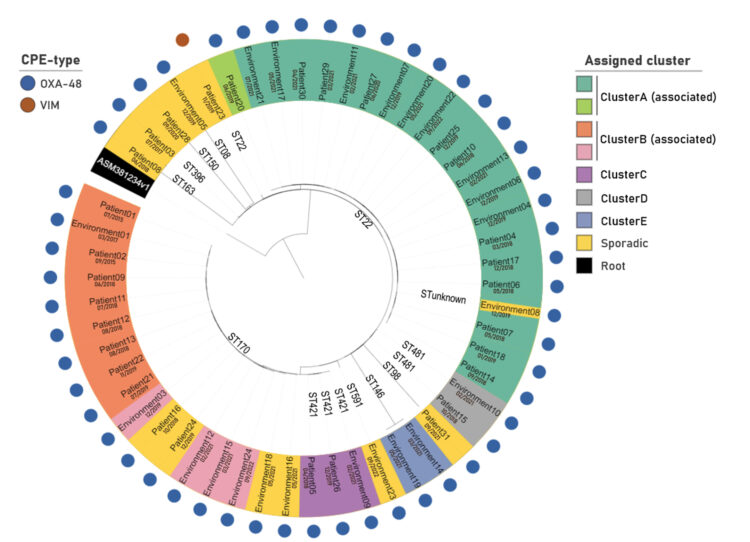
Een cladogram visualiseert de resultaten van de hiërarchische clustering van cgMLST analyse. Bacteriële isolaten die in een cluster zitten (groen, rood, paars, grijs, blauw) hebben onderling minder dan 20 allelen verschil. Isolaten die geassocieerd zijn hebben onderling minder dan 40 allelen verschil. Alle andere worden gecategoriseerd als “sporadisch” (geel).
Figuur 3: Visualisatie van 53 Citrobacter freundii-isolaten in de loop van de tijd op basis van de verzamellocatie [1].
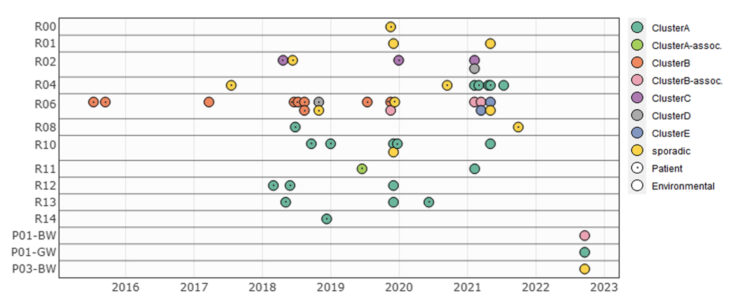
BW=bruin water, GW=grijs water, P=groep afvalwaterleidingen (P01 verzamelt kamers R01 tot R09; P03 verzamelt kamers R10 tot R16), R=kamernummer van de patiënt. De bacteriële isolaten zijn gekleurd op basis van toegewezen cluster, patiënt-isolaten worden aangegeven met een binnenste stip.
Referenties
1. Hamerlinck, H., et al., Sanitary installations and wastewater plumbing as reservoir for the long-term circulation and transmission of carbapenemase producing Citrobacter freundii clones in a hospital setting. Antimicrob Resist Infect Control, 2023. 12(1): p. 58.
2. Tacconelli, E., et al., Discovery, research, and development of new antibiotics: the WHO priority list of antibiotic-resistant bacteria and tuberculosis. The Lancet Infectious Diseases, 2018. 18(3): p. 318-327.
3. Kizny Gordon, A.E., et al., The Hospital Water Environment as a Reservoir for Carbapenem-Resistant Organisms Causing Hospital-Acquired Infections-A Systematic Review of the Literature. Clin Infect Dis, 2017. 64(10): p. 1435-1444.
4. Tischendorf, J., R.A. de Avila, and N. Safdar, Risk of infection following colonization with carbapenem-resistant Enterobactericeae: A systematic review. Am J Infect Control, 2016. 44(5): p. 539-43.
5. Lipsky, B.A.H.I., E. W.; Smith, A. A.; Plorde, J. J., Citrobacter Infections in Humans: Experience at the Seattle Veterans Administration Medical Center and a Review of Literature. Reviews of Infectious Diseases, 1980. 2(5).
6. Yao, Y., et al., Carbapenem-Resistant Citrobacter spp. as an Emerging Concern in the Hospital-Setting: Results From a Genome-Based Regional Surveillance Study. Front Cell Infect Microbiol, 2021. 11: p. 744431.
7. Jolivet, S., et al., Outbreak of OXA-48-producing Enterobacterales in a haematological ward associated with an uncommon environmental reservoir, France, 2016 to 2019. Euro Surveill, 2021. 26(21).
8. Smismans, A., et al., New environmental reservoir of CPE in hospitals. The Lancet Infectious Diseases, 2019. 19(6): p. 580-581.
9. Heireman, L., et al., Toilet drain water as a potential source of hospital room-to-room transmission of carbapenemase-producing Klebsiella pneumoniae. J Hosp Infect, 2020. 106(2): p. 232-239.
10. Park, S.C., et al., Risk Factors Associated with Carbapenemase-Producing Enterobacterales (CPE) Positivity in the Hospital Wastewater Environment. Appl Environ Microbiol, 2020. 86(24).
11. Knowlton, S.D., et al., Bioaerosol concentrations generated from toilet flushing in a hospital-based patient care setting. Antimicrob Resist Infect Control, 2018. 7: p. 16.
12. Arena, F., et al., Droplets generated from toilets during urination as a possible vehicle of carbapenem-resistant Klebsiella pneumoniae. Antimicrob Resist Infect Control, 2021. 10(1): p. 149.
13. Neidhofer, C., et al., Hospital sanitary facilities on wards with high antibiotic exposure play an important role in maintaining a reservoir of resistant pathogens, even over many years. Antimicrob Resist Infect Control, 2023. 12(1): p. 33.
14. Kotay, S., et al., Spread from the Sink to the Patient: In Situ Study Using Green Fluorescent Protein (GFP)-Expressing Escherichia coli To Model Bacterial Dispersion from Hand-Washing Sink-Trap Reservoirs. Appl Environ Microbiol, 2017. 83(8).
15. Shaw, E., et al., Control of endemic multidrug-resistant Gram-negative bacteria after removal of sinks and implementing a new water-safe policy in an intensive care unit. J Hosp Infect, 2018. 98(3): p. 275-281.
16. Jamal, A.J., et al., Standard versus combined chemical, mechanical, and heat decontamination of hospital drains harboring carbapenemase-producing organisms (CPOs): A randomized controlled trial. Infect Control Hosp Epidemiol, 2021. 42(10): p. 1275-1278.
Nieuwigheden
Wetenschappelijke agenda
- oktober 2024
-
van 16/10 tot 20/10 || in Los Angeles
SHEA ID week. A joint meeting of IDSA, SHEA, HIVMA, PIDS and SIDP
- november 2024
-
van 20/11 tot 22/11 || in Liverpool
Healthcare infection society
- april 2025
-
van 11/04 tot 15/04 || in Wenen
Congrès de l’ European Society of Clinical Microbiology and Infectious Diseases (ESCMID)
- juni 2025
-
van 4/06 tot 6/06 || in Marseille
35ème Congrès National de la Société Française d’Hygiène Hospitalière (SF2H)
-
van 17/06 tot 18/06 || in Londen
HIS congres (Healthcare Infection Society)



