Prevalentie en risicofactoren voor MRSA-dragerschap bij de opname in een geriatrische afdeling
Naar een artikel gepubliceerd in The Journal of Hospital Infection: « Prevalence and factors associated with methicillin-resistant Staphylococcus aureus (MRSA) colonisation on admission to geriatric care units: impact on screening practices » A. Bruyneel, I. Miesse, D. Mathieu, C. Djuidjé Yuemo, A. Simon

Inleiding
Hoewel de prevalentie volgens Sciensano (Latour, Goossens, Hallin, & Huang, 2020), de laatste jaren afneemt, blijft methicillineresistente Staphylococcus aureus (MRSA) verantwoordelijk voor tal van infecties met een hoge morbiditeit en mortaliteit (Dantes et al., 2013; Li et al., 2021). Deze infecties kunnen leiden tot een langere verblijfsduur, meer heropnames en meer nood aan specifieke behandelingen, die allemaal de kosten voor de sociale zekerheid en de ziekenhuizen verhogen (Andreassen et al., 2017; European Centre for Disease Prevention and Control (ECDC), 2009; Nelson et al., 2022). In onze regio zijn veel mensen asymptomatische dragers van MRSA. Naar schatting zal 9 tot 33% van hen ooit een MRSA-infectie melden (Popovich et al., 2023).
In de geriatrische populatie komen MRSA-besmettingen en MRSA-bacteriëmieën vaker voor dan in de algemene bevolking. De sterftecijfers na een MRSA-bacteriëmie zijn ook hoger bij oudere patiënten (Cuervo et al., 2016). Deze populatie, met zijn specifieke kenmerken, vereist dus speciale aandacht als het gaat om MRSA. Momenteel bestaat er echter geen consensus over MRSA-screening bij de geriatrische populatie.
Een studie die recentelijk in Duitsland werd uitgevoerd, werd gepubliceerd in Nature (Raschpichler et al., 2020). Op basis van een systematische MRSA-screening bij patiënten die in de spoedgevallenafdeling werden opgenomen, konden 3 criteria aan het licht worden gebracht: de patiënt is al eerder drager van MRSA geweest, de patiënt heeft chronische zorg nodig en de patiënt wordt behandeld voor kanker. De screening van de patiënten op MRSA volgens deze criteria vermindert het aantal gescreende patiënten tot 25% van de opnames, met behoud van een goede sensitiviteit en specificiteit. Aangezien de studie werd uitgevoerd bij patiënten die werden opgenomen in de spoedgevallenafdeling, zijn de resultaten echter niet als dusdanig toepasbaar op geriatrische afdelingen.
Bijgevolg heeft deze studie als doel het bepalen van de prevalentie van MRSA bij de opname in de geriatrische ziekenhuisafdelingen en het identificeren van de risicofactoren voor MRSA-dragerschap in deze context. Op basis van deze resultaten zal een screeningsmodel – op basis van de criteria die zijn afgeleid uit de risicofactoren – worden getest.
Methode
Het gaat om een case-controle studie (1: 1), uitgevoerd in de geriatrische afdelingen van zes ziekenhuissites van het netwerk Helora. Deze sites werden geselecteerd omdat de patiënten er systematisch worden gescreend op MRSA bij opname op de geriatrische afdeling via een gepoold uitstrijkje (neus-keel-perineum) en uitstrijkjes ter hoogte van wonden en lichaamsvreemd materiaal indien van toepassing. Bovendien worden de stalen die voor de MRSA-screening worden afgenomen, in alle geïncludeerde ziekenhuissites op dezelfde manier geanalyseerd. De retrospectieve studie werd uitgevoerd op basis van de dossiers van de patiënten die tussen 1 januari 2021 en 31 december 2022 in deze eenheden werden opgenomen.
Een case wordt gedefinieerd als een patiënt die is opgenomen in één van de geïncludeerde geriatrische afdelingen, en bij wie binnen 48 uur na opname een MRSA-screening is uitgevoerd die positief werd bevonden. Een controle wordt gedefinieerd als een patiënt die in hetzelfde jaar als de case waarmee wordt vergeleken is opgenomen in één van de geïncludeerde geriatrische afdelingen , en die binnen 48 uur na opname werd gescreend op MRSA en bij wie de screening negatief werd bevonden.
De gegevens van de opgenomen patiënten werden verzameld op basis van hun elektronisch patiëntendossier. Het gaat om de plaats van MRSA-dragerschap voor de cases en, voor zowel de cases als de controlepatiënten, om de risicofactoren voor MRSA-dragerschap beschreven in de wetenschappelijke literatuur (Jans et al., 2013; Latour et al., 2019; Raschpichler et al., 2020; Roth et al., 2016). Deze gegevens werden eerst geanalyseerd met univariate methoden en daarna met een multivariate analysemethode, steeds met een foutenmarge van 5%.
Resultaten
Figuur 1 toont voor elke ziekenhuissite de jaarlijkse prevalentie van MRSA bij opname per 100 patiënten die werden opgenomen in een geriatrische ziekenhuisafdeling, met een betrouwbaarheidsinterval van 95%.
Figuur 1: Prevalentie van MRSA bij opname (uitgedrukt per 100 patiënten) in de verschillende ziekenhuissites (periode 2021-2022)
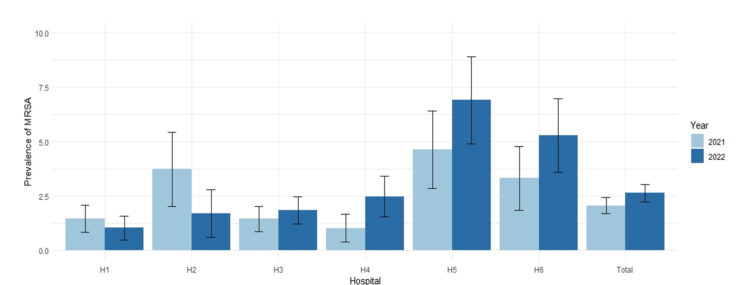
Hieruit blijkt dat de prevalentie van MRSA sterk varieert, zowel tussen de ziekenhuissites als van jaar tot jaar. De prevalenties zijn echter vergelijkbaar voor de ziekenhuissites van eenzelfde zorggebied (H1 en H3).
De plaatsen van MRSA-dragerschap bij de cases (neus-keel-perineum of klinische site) worden weergegeven in figuur 2.
Figuur 2: Verdeling van de cases volgens plaatsen van MRSA-dragerschap
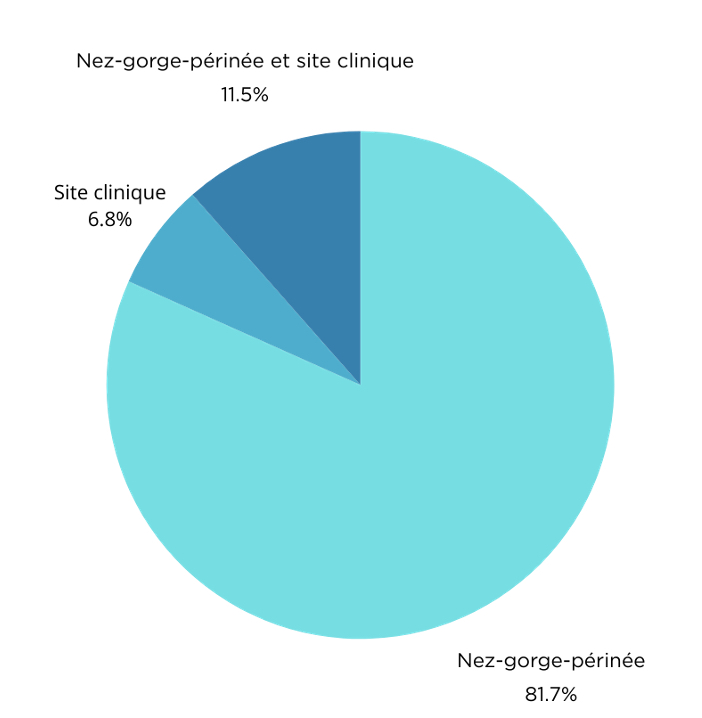
In de meeste gevallen bevindt het MRSA-dragerschap zich in de neus, keel en/of perineum. In zeldzamere gevallen wordt gelijktijdig dragerschap gevonden ter hoogte van een klinische site (wonde, urine, lichaamsvreemd voorwerp) en in de neus, keel en/of perineum. Ten slotte zijn de klinische sites die gekoloniseerd of geïnfecteerd zijn met MRSA in combinatie met een negatieve screening ter hoogte van neus, keel en perineum zeer zeldzaam.
De sociodemografische beschrijving van de steekproef op het moment van opname in functie van de verschillende groepen wordt weergegeven in tabel 1.
Tabel 1: Sociodemografische kenmerken bij opname van cases en controles
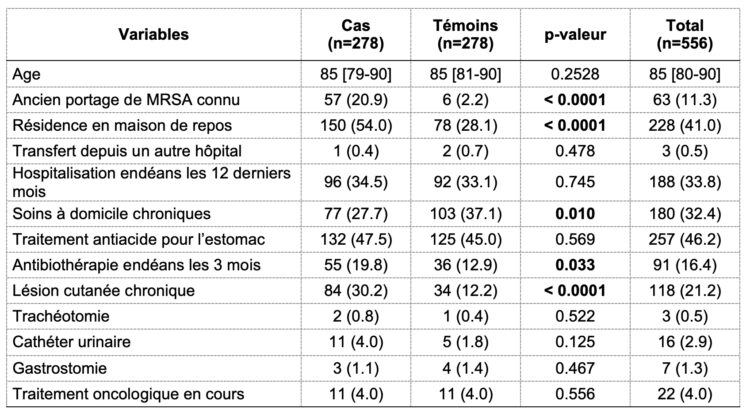
Legende: absolute frequentie (relatieve frequentie); mediaan [p25-p75].
Volgens de resultaten van de univariate analysemethode is er een significant verschil tussen de cases en controles voor de volgende variabelen: gekend MRSA-dragerschap, verblijf in een woonzorgcentrum, chronische thuiszorg (frequenter bij de controlepatiënten), antibioticabehandeling in de afgelopen 3 maanden en chronische huidlaesie. Deze variabelen werden vervolgens opgenomen in een multivariaat analysemodel waarvan de aangepaste odds ratio’s en p-waarden worden weergegeven in tabel 2.
Tabel 2: Variabelen uit het multivariaat analysemodel met adjusted odds ratio en p-waarde
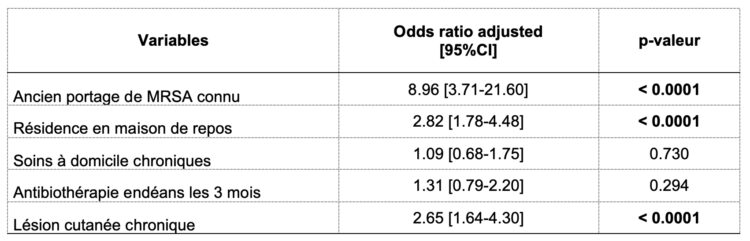
Uit deze analyse blijkt dat de risicofactoren voor MRSA-dragerschap bij opname in een geriatrische afdeling de volgende zijn: gekend MRSA-dragerschap, verblijf in een woonzorgcentrum en de aanwezigheid van chronische huidlaesies. Door het toepassen van een MRSA-screeningsmodel gebaseerd op de aanwezigheid van één van deze drie criteria op onze steekproef, is het gebied onder de ROC-curve (figuur 3) 73%, terwijl de sensitiviteit en specificiteit van het model respectievelijk 72,3% (CI 95%: 69,8-75,7%) en 62,6% (CI 95%: 58,2-66,4%) bedragen. Bij gebruik van deze screeningscriteria in plaats van een systematische screening zou slechts 55% van de opgenomen patiënten gescreend worden.
Figuur 3: Gebied onder de ROC-curve voor het screeningsmodel op basis van 3 criteria
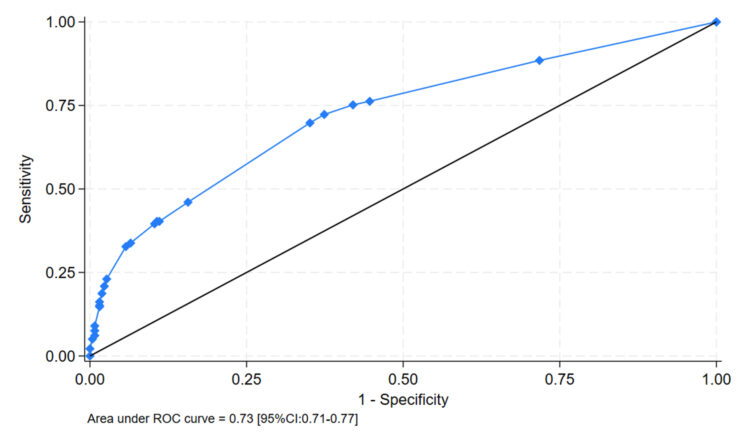
Legende: AUROC, area under the receiver operating characteristic
Bespreking
Deze studie heeft betrekking op de prevalentie en de risicofactoren voor MRSA-dragerschap bij opname in een geriatrische afdeling. De resultaten van dit onderzoek maken verschillende vaststellingen mogelijk.
Ten eerste kan de prevalentie van MRSA-dragerschap bij opname in de bestudeerde afdelingen als laag worden beschouwd in vergelijking met de resultaten van verschillende studies over dit onderwerp, zowel in vergelijking met geriatrische afdelingen (Dulon et al., 2011; Nitti et al., 2023; Sax et al., 2005) als, meer in het algemeen, acute afdelingen (Dulon et al., 2011; Marzec en Bessesen, 2016; Roth et al., 2016). Bovendien kan de heterogeniteit van deze prevalentie tussen de verschillende ziekenhuissites – zeker gedeeltelijk – worden verklaard door de herkomst van veel patiënten uit 2 specifieke rusthuizen. Deze rusthuizen werden geïdentificeerd en hun verantwoordelijken en de regionale autoriteiten werden geïnformeerd over de mogelijk hoge prevalentie van MRSA bij hun bewoners.
Ten tweede zijn de risicofactoren voor MRSA-dragerschap die in deze studie aan het licht gebracht worden (gekend MRSA-dragerschap, verblijf in een woonzorgcentrum en aanwezigheid van een chronische wonde) al aangehaald door de auteurs van andere studies over dit onderwerp (Harbarth et al., 2006, 2008; Raschpichler et al., 2020; Tacconelli et al., 2009). Aan de andere kant kunnen bepaalde risicofactoren voor MRSA-dragerschap die in de wetenschappelijke literatuur worden vermeld, in deze studie niet als risicofactoren worden beschouwd. De artikels die risicofactoren presenteren die niet terug te vinden zijn in de resultaten van deze studie, richten zich echter niet op de specifieke kenmerken van de geriatrische populatie of zijn uitgevoerd in een tijdperk waarin de prevalentie van MRSA veel hoger was dan tegenwoordig (Sax et al., 2005).
Daarnaast is het belangrijk om alle voor- en nadelen van de toepassing van een screeningsmodel op basis van de hier voorgestelde criteria te beoordelen. Vergeleken met een systematische screening van de opgenomen patiënten, kan de toepassing van een dergelijk model de kosten in verband met screening verlagen, de werkdruk voor het personeel in de gezondheidszorg verminderen en het comfort voor de patiënt verhogen. Bovendien lijkt gerichte screening op MRSA kosteneffectiever dan een systematische screening (Dymond et al., 2020; Joubert et al., 2022; Raschpichler et al., 2020). Een Canadese studie heeft aangetoond dat met een systematische screening weliswaar drie keer zoveel patiënten met MRSA geïdentificeerd konden worden, maar dat de nosocomiale verwervingen van MRSA hiermee niet verminderd konden worden (Roth et al., 2016). Er moet echter aandacht worden besteed aan een mogelijke toename van de kolonisatie van patiënten met MRSA, wat negatieve gevolgen kan hebben voor de patiënten. De toepassing van het geriatrische screeningsmodel volgens de 3 genoemde criteria zal echter niet leiden tot een grote toename van de transmissie van MRSA binnen de ziekenhuizen, aangezien de aanwezigheid van een huidwonde één van de screeningcriteria is. Verschillende onderzoeken hebben immers aangetoond dat patiënten die drager zijn van deze kiem in een chronische wonde, de grootste verspreiders van MRSA waren (Campbell et al., 2004; Peters et al., 2017). Met het voorgestelde model zouden deze verspreiders worden geïdentificeerd en zouden maatregelen genomen kunnen worden om het risico op besmetting van andere patiënten te beperken.
Ten slotte hebben de aanbevelingen voor een systematische screening van alle patiënten bij opname enkel betrekking op ziekenhuizen met een hoge MRSA-prevalentie bij opname of op sporadische gevallen van plotselinge toename van de MRSA-incidentie.
Limieten
Deze studie heeft verschillende limieten. Ten eerste werd er geen weging toegekend aan de risicofactorendie leidde tot een screeningscore op basis van hun belang. De identificatie van een risicofactor voor screening, is echter gemakkelijker te gebruiken dan de berekening van een score op basis van risicofactoren.. Ten tweede lijkt de grootte van de steekproef beperkt in vergelijking met die van andere studies over dit onderwerp. Deze studie is echter multicentrisch en omvat de gegevens van twee jaren. Ten derde werden de geanalyseerde factoren geselecteerd op basis van de literatuur over risicofactoren voor MRSA-dragerschap, maar ook andere factoren hadden in het multivariate model opgenomen kunnen worden. Ten vierde is dit een observationele studie, wat kan leiden tot selectie- en observatiebias. Bovendien werden de gegevens verzameld op basis van patiëntendossiers. Sommige gegevens konden dus ontbreken. Ten slotte kon het percentage patiënten dat bij opname op MRSA werd getest, niet worden verzameld, wat als een selectiebias kan worden beschouwd.
Conclusies
De prevalentie van MRSA-dragerschap bij opname in de geriatrische afdelingen was laag in deze studie. Er werden echter significante verschillen in prevalentie waargenomen tussen de betrokken ziekenhuizen. Drie risicofactoren voor MRSA-dragerschap werden geïdentificeerd: gekend MRSA-dragerschap, de aanwezigheid van een chronische huidwonde en verblijf in een woonzorgcentrum. Het gebruik van deze risicofactoren als screeningscriteria in geriatrische afdelingen zou het aantal patiënten dat wordt gescreend op MRSA kunnen verminderen, terwijl de sensitiviteit en specificiteit aanvaardbaar blijven.
Bibliografie
1. Andreassen AES, Jacobsen CM, De Blasio B, et al. (2017) The impact of methicillin-resistant S. aureus on length of stay, readmissions and costs: a register based case-control study of patients hospitalized in Norway. Antimicrobial Resistance & Infection Control 6(1): 74. DOI: 10.1186/s13756-017-0232-x.
2. Barlow G, Duffy S, Monnet D, et al. (2017) Economic Evaluations of Interventions to Prevent Healthcare-Associated Infections Literature Review. Stockholm: ECDC.
3. Campbell KM, Vaughn AF, Russell KL, et al. (2004) Risk factors for community-associated methicillin-resistant Staphylococcus aureus infections in an outbreak of disease among military trainees in San Diego, California, in 2002. Journal of Clinical Microbiology 42(9): 4050–4053. DOI: 10.1128/JCM.42.9.4050-4053.2004.
4. Carrington AM, Manuel DG, Fieguth PW, et al. (2023) Deep ROC Analysis and AUC as Balanced Average Accuracy, for Improved Classifier Selection, Audit and Explanation. IEEE Transactions on Pattern Analysis and Machine Intelligence 45(1): 329–341. DOI: 10.1109/TPAMI.2022.3145392.
5. Chrétien L, Massicotte Josée and Pilon PA (2006) Mesures de prévention et de contrôle des infections à Staphylococcus aureus résistant à la méthicilline (SARM) au Québec: guide de prévention et de contrôle à l’intention des établissements de soins. 2e ed., tussentijdse versie. Montreal: L’Institut : AMMIQ.
6. Cuervo G, Gasch O, Shaw E, et al. (2016) Clinical characteristics, treatment and outcomes of MRSA bacteraemia in the elderly. Journal of Infection 72(3): 309–316. DOI: 10.1016/j.jinf.2015.12.009.
7. Cuschieri S (2019) The STROBE guidelines. Saudi Journal of Anaesthesia 13(Suppl 1): S31–S34. DOI: 10.4103/sja.SJA_543_18.
8. Dantes R, Mu Y, Belflower R, et al. (2013) National burden of invasive methicillin-resistant Staphylococcus aureus infections, United States, 2011. JAMA internal medicine 173(21): 1970–1978. DOI: 10.1001/jamainternmed.2013.10423.
9. Denis O, Jans B, Deplano A, et al. (2009) Epidemiology of methicillin-resistant Staphylococcus aureus (MRSA) among residents of nursing homes in Belgium. Journal of Antimicrobial Chemotherapy 64(6): 1299–1306. DOI: 10.1093/jac/dkp345.
10. Dulon M, Haamann F, Peters C, et al. (2011) MRSA prevalence in european healthcare settings: a review. BMC Infectious Diseases 11(1): 138. DOI: 10.1186/1471-2334-11-138.
11. Dymond A, Davies H, Mealing S, et al. (2020) Genomic Surveillance of Methicillin-resistant Staphylococcus aureus: A Mathematical Early Modeling Study of Cost-effectiveness. Clinical Infectious Diseases 70(8): 1613–1619. DOI: 10.1093/cid/ciz480.
12. Elias J, Heuschmann PU, Schmitt C, et al. (2013) Prevalence dependent calibration of a predictive model for nasal carriage of methicillin-resistant Staphylococcus aureus. BMC infectious diseases 13: 111. DOI: 10.1186/1471-2334-13-111.
13. European Centre for Disease Prevention and Control (ECDC) (ed.) (2009) The Bacterial Challenge, Time to React: A Call to Narrow the Gap between Multidrug-Resistant Bacteria in the EU and the Development of New Antibacterial Agents. ECDC/ EMEA joint technical report. Stockholm: ECDC. DOI: 10.2900/2518.
14. Harbarth S, Sax H, Fankhauser-Rodriguez C, et al. (2006) Evaluating the probability of previously unknown carriage of MRSA at hospital admission. The American Journal of Medicine 119(3): 275.e15–23. DOI: 10.1016/j.amjmed.2005.04.042.
15. Harbarth S, Sax H, Uckay I, et al. (2008) A predictive model for identifying surgical patients at risk of methicillin-resistant Staphylococcus aureus carriage on admission. Journal of the American College of Surgeons 207(5): 683–689. DOI: 10.1016/j.jamcollsurg.2008.05.023.
16. High Council for Health (2019) Recommendations for the prevention, control and management of patients carrying multidrug-resistant bacteria in healthcare settings (MDRO). Available at: https://www.health.belgium.be/sites/default/files/uploads/fields/fpshealth_theme_file/20200910_css-9277_mdro_update_vweb.pdf (geraadpleegd op 8 augustus 2023).
17. Huang SS, Singh R, McKinnell JA, et al. (2019) Decolonization to Reduce Postdischarge Infection Risk among MRSA Carriers. New England Journal of Medicine 380(7): 638–650. DOI: 10.1056/NEJMoa1716771.
18. Jans B, Schoevaerdts D, Huang T-D, et al. (2013) Epidemiology of Multidrug-Resistant Microorganisms among Nursing Home Residents in Belgium. PLoS ONE Kluytmans J (ed.) 8(5): e64908. DOI: 10.1371/journal.pone.0064908.
19. Joubert D, Cullati S, Briot P, et al. (2022) How to improve hospital admission screening for patients at risk of multidrug-resistant organism carriage: a before-and-after interventional study and cost-effectiveness analysis. BMJ Open Quality 11(2): e001699. DOI: 10.1136/bmjoq-2021-001699.
20. Latour K, Huang T-D, Jans B, et al. (2019) Prevalence of multidrug-resistant organisms in nursing homes in Belgium in 2015. PLOS ONE Kluytmans J (ed.) 14(3): e0214327. DOI: 10.1371/journal.pone.0214327.
21. Latour K, Denis O, Goossens H, et al. (2022) Epidemiology and public health – Healthcare-associated infections and antimicrobial resistance. ISSN: 2593-7073. Sciensano. Available at: https://www.sciensano.be/fr/biblio/surveillance-antimicrobial-resistant-bacteria-belgian-hospitals-report-2019-2020 (geraadpleegd op 30 augustus 2023).
22. Latour K, Catry B, Devleesschauwer B, et al. (2022) Healthcare-associated infections and antimicrobial use in Belgian nursing homes: results of three point prevalence surveys between 2010 and 2016. Archives of Public Health = Archives Belges De Sante Publique 80(1): 58. DOI: 10.1186/s13690-022-00818-1.
23. Li Z, Zhuang H, Wang G, et al. (2021) Prevalence, predictors, and mortality of bloodstream infections due to methicillin-resistant Staphylococcus aureus in patients with malignancy: systemic review and meta-analysis. BMC infectious diseases 21(1): 74. DOI: 10.1186/s12879-021-05763-y.
24. Marzec NS and Bessesen MT (2016) Risk and outcomes of methicillin-resistant Staphylococcus aureus (MRSA) bacteremia among patients admitted with and without MRSA nares colonization. American Journal of Infection Control 44(4): 405–408. DOI: 10.1016/j.ajic.2015.11.006.
25. Nelson RE, Hyun D, Jezek A, et al. (2022) Mortality, Length of Stay, and Healthcare Costs Associated With Multidrug-Resistant Bacterial Infections Among Elderly Hospitalized Patients in the United States. Clinical Infectious Diseases 74(6): 1070–1080. DOI: 10.1093/cid/ciab696.
26. Nitti MT, Sleghel F, Kaczor M, et al. (2023) Colonization of Residents and Staff of an Italian Long-Term Care Facility and an Adjacent Acute Care Hospital Geriatrics Unit by Multidrug-Resistant Bacteria. Microbial Drug Resistance: mdr.2023.0019. DOI: 10.1089/mdr.2023.0019.
27. Peters C, Dulon M, Kleinmüller O, et al. (2017) MRSA Prevalence and Risk Factors among Health Personnel and Residents in Nursing Homes in Hamburg, Germany – A Cross-Sectional Study. PloS One 12(1): e0169425. DOI: 10.1371/journal.pone.0169425.
28. Popovich KJ, Aureden K, Ham DC, et al. (2023) SHEA/IDSA/APIC Practice Recommendation: Strategies to prevent methicillin-resistant Staphylococcus aureus transmission and infection in acute-care hospitals: 2022 Update. Infection Control & Hospital Epidemiology 44(7): 1039–1067. DOI: 10.1017/ice.2023.102.
29. Raschpichler G, Raupach-Rosin H, Akmatov MK, et al. (2020) Development and external validation of a clinical prediction model for MRSA carriage at hospital admission in Southeast Lower Saxony, Germany. Scientific Reports 10(1): 17998. DOI: 10.1038/s41598-020-75094-6.
30. Roth VR, Longpre T, Coyle D, et al. (2016) Cost Analysis of Universal Screening vs. Risk Factor-Based Screening for Methicillin-Resistant Staphylococcus aureus (MRSA). PLOS ONE Schildgen O (ed.) 11(7): e0159667. DOI: 10.1371/journal.pone.0159667.
31. Sasahara T, Ae R, Yoshimura A, et al. (2020) Association between length of residence and prevalence of MRSA colonization among residents in geriatric long-term care facilities. BMC Geriatrics 20(1): 481. DOI: 10.1186/s12877-020-01885-1.
32. Sax H, Harbarth S, Gavazzi G, et al. (2005) Prevalence and prediction of previously unknown MRSA carriage on admission to a geriatric hospital. Age and Ageing 34(5): 456–462. DOI: 10.1093/ageing/afi135.
33. Schubert M, Clarke SP, Aiken LH, et al. (2012) Associations between rationing of nursing care and inpatient mortality in Swiss hospitals. International Journal for Quality in Health Care 24(3): 230–238. DOI: 10.1093/intqhc/mzs009.
34. Suetens C, Niclaes L, Jans B, et al. (2006) Methicillin-Resistant Staphylococcus aureus Colonization Is Associated with Higher Mortality in Nursing Home Residents with Impaired Cognitive Status: MRSA: HIGHER MORTALITY IN NURSING HOMES. Journal of the American Geriatrics Society 54(12): 1854–1860. DOI: 10.1111/j.1532-5415.2006.00972.x.
35. Tacconelli E, De Angelis G, de Waure C, et al. (2009) Rapid screening tests for meticillin-resistant Staphylococcus aureus at hospital admission: systematic review and meta-analysis. The Lancet. Infectious Diseases 9(9): 546–554. DOI: 10.1016/S1473-3099(09)70150-1.
36. Vincent J-L, Sakr Y, Singer M, et al. (2020) Prevalence and Outcomes of Infection Among Patients in Intensive Care Units in 2017. JAMA 323(15): 1478. DOI: 10.1001/jama.2020.2717.
Nieuwigheden
Wetenschappelijke agenda
- september 2025
-
van 16/09 tot 19/09 || in Geneva
International Conference on Prevention and Infection control (ICPIC)
- oktober 2025
-
9/10
Symposium de la Belgian Infection Control Society (BICS)
-
van 19/10 tot 22/10 || in Atlanta
Society for Health Care Epidemiology of America (SHEA)
- december 2025
-
van 15/12 tot 16/12 || in Parijs
46ème Réunion interdisciplinaire de chimiothérapie infectieuse (RICAI)
- juni 2026
-
van 5/06 tot 6/06 || in Rijsel
36ème Congrès de la Société Française en Hygiène Hospitalière (SF2H)



