Nieuwe EUCAST-criteria voor de interpretatie van het antibiogram: Wat is de impact voor de ziekenhuishygiëneteams bij de screening, preventie en bestrijding van MDRO’s?

Maar wat is EUCAST eigenlijk? Reminder bij wijze van inleiding:
Het Europees Comité voor tests op antimicrobiële resistentie (EUCAST) is het wetenschappelijk comité belast met het vastleggen van richtsnoeren voor de interpretatie van het antibiogram. EUCAST is een samenwerking tussen de ESCMID (de Europese vereniging voor medische microbiologie en infectieziekten), het ECDC (het Europese Centrum voor Ziektepreventie en -controle) en andere Europese laboratoria. Het EUCAST definieert de klinische breekpunten op basis waarvan de resultaten van het antibiogram in categorieën kunnen worden ingedeeld (als SRI-resultaten: Gevoelig, Intermediair of Resistent). Dit helpt bij het klinisch gebruik van antibiotica (in overeenstemming met het Europees Geneesmiddelenbureau, EMA) en bij de epidemiologische surveillance van resistentie (in overeenstemming met het ECDC). Sinds zijn oprichting in 1997 heeft het EUCAST-comité een beslissende bijdrage geleverd aan de harmonisatie van de surveillance van antibioticaresistentie in Europa, waar het intussen de standaardreferentie van het antibiogram is en door de overgrote meerderheid van de laboratoria voor klinische biologie wordt gebruikt (>90% in België). Het EUCAST richt zich in de eerste plaats op de technische aspecten van de antibiogrammen en helpt het klinisch gebruik van antimicrobiële agentia te optimaliseren door voor elk antibioticum, geïndividualiseerde klinische breekpunten vast te stellen. Deze «klinische breekpunten” vertegenwoordigen de gebruikte concentratie antibioticum om te bepalen of een infectie die door een bepaalde bacteriestam wordt veroorzaakt, waarschijnlijk doeltreffend kan worden behandeld bij de patiënt. In dit geval wordt de stam «gevoelig» genoemd. Er zij op gewezen dat het EUCAST weliswaar ook aanbevelingen doet voor de screening van resistentiemechanismen die van klinisch en/of epidemiologisch belang zijn (bijv. ESBL’s, carbapenemases, enz.), maar er helemaal geen formuleert voor de screening van het dragerschap van overdraagbare resistente bacteriën die ziekenhuisinfecties veroorzaken, noch voor de toe te passen preventie- en/of controlemaatregelen.
In 2019 heeft EUCAST nieuwe definities en criteria voor de interpretatie van de resultaten van het antibiogram uitgevaardigd. Deze hebben met name betrekking op categorie «I» (voorheen «Intermediair» genoemd), waarvan de oorspronkelijke definitie verwees naar hetzij een niet nader omschreven resultaat (als gevolg van technische onzekerheid (variatie in de methode of interpretatie van het resultaat), hetzij een grensconcentratie van het antibioticum op de plaats van de infectie (die onzekerheid omtrent de klinische efficiëntie veroorzaakt). Deze indeling in categorieën van de «I»-resultaten werd door de clinici vaak verkeerd begrepen en leidde ertoe dat de gerapporteerde antibiotica niet werden gebruikt. Bovendien werden de resultaten van de categorieën «I» (intermediair) en «R» (resistent) in epidemiologische surveillanceprogramma’s het vaakst gegroepeerd als «niet-gevoelige» resultaten. Dit heeft er ook voor gezorgd dat clinici antibiotica die bij het antibiogram als «I» waren ingedeeld, liever niet gebruikten voor de behandeling van patiënten.
Sinds 2020 beveelt het EUCAST aan dat laboratoria de «I»-categorie behouden (referendum uitgevoerd door het EUCAST tussen 2015 en 2019), maar met een nieuwe betekenis; deze laatste wordt voortaan beschouwd als een indicatie van gevoeligheid, mits hogere doseringen worden gebruikt (Susceptible, Increased Exposure), terwijl de «S»-categorie verwijst naar een gevoeligheid bij standaarddosering. De «I»-categorie weerspiegelt een lagere natuurlijke (intrinsieke) gevoeligheid van bepaalde bacteriesoorten (bijv.: Pseudomonas aeruginosa) voor antibiotica en de noodzaak om hogere doseringen van bepaalde antibiotica te gebruiken. Ze kan ook wijzen op de aanwezigheid van resistentiemechanismen van de bacterie maar die zwak uitgedrukt zijn en zo de gevoeligheid ervan verminderen. Het EUCAST heeft deze nieuwe indeling in categorieën en de interpretatieregels op basis van het gebruik van nieuwe klinische breekpunten voor alle antimicrobiële agentia (oude en nieuwe) volledig herzien. Voortaan wordt dus rekening gehouden met de verschillende doseringen die klinisch worden gebruikt (standaarddosis (S) en hogere dosis (I)).
De impact van deze nieuwe aanbevelingen (met name het ontbreken in sommige gevallen, afhankelijk van de ziekteverwekker en het antibioticum, van een «S»-categorie en de vervanging ervan door één enkele «I»-categorie (gevoelig bij hogere dosering)) betreft in de eerste plaats het beheer van antimicrobiële agentia en in de tweede plaats de mogelijke gevolgen van deze veranderingen voor de keuze van antibioticamoleculen en therapeutische strategieën, met name in ziekenhuizen (agentia die parenteraal (IV) worden gebruikt, dosering aangepast aan het soort micro-organisme, enz.). Daarom is het van essentieel belang dat de multidisciplinaire antibioticabeleidsgroepen (ABG’s) in de ziekenhuizen nagaan of de gebruikte antibioticadoseringen overeenstemmen met de door het EUCAST aanbevolen doseringen, en dat deze zo nodig worden gewijzigd. De laboratoria moeten de ziekenhuisclinici (maar ook de artsen in de ambulante geneeskunde) informeren over de veranderingen die uit deze nieuwe criteria voortvloeien en over de gevolgen daarvan voor de behandeling van de patiënten.
De impact die deze categorieveranderingen zullen hebben op de surveillance van antimicrobiële resistentie is echter nog niet bekend en moet zowel op nationaal als op lokaal niveau worden opgevolgd.
Over het algemeen is het belangrijk dat de laboratoria in hun epidemiologische surveillanceverslagen een duidelijk onderscheid maken tussen resistente (R) en gevoelige (S + I) stammen. Globalisering in de categorie «niet-gevoelig» (R+ I), die in het verleden vaak werd gebruikt in surveillances (zowel lokaal als nationaal), is niet langer aanvaardbaar.
Wat de zogenaamde multiresistente bacteriën betreft, vaak «Multi-drug Resistant Organisms (MDRO)” genoemd, bestaat er tot op heden helaas geen consensus over de criteria voor het definiëren daarvan in het kader van de preventie- en bestrijdingsmaatregelen die moeten worden toegepast op gehospitaliseerde patiënten die drager zijn van deze bacteriën. Sommige landen, zoals Duitsland en Nederland, hebben nationale aanbevelingen gepubliceerd op basis van verschillende definities (J. Müller et al. Antimicrobial Resistance and Infection Control 2015; 4:7).
In Europa heeft het ECDC, via een internationale consensus van deskundigen (AP Magiorakos et al. Clin Microb Infect 2012, 18(3): 268-81) een reeks definities voorgesteld om te komen tot een internationale standaardterminologie voor de criteria die worden gebruikt om een profiel van verworven meervoudig resistentie te karakteriseren bij de belangrijkste bacteriële pathogenen die ziekenhuisinfecties veroorzaken. Voor elke bacteriegroep werden antibioticaklassen en de verschillende moleculen binnen elke in aanmerking genomen klasse, samengesteld en voorgesteld. Dit houdt in dat de laboratoria de antibiotica testen die nodig zijn om MDRO’s op te sporen en dat ze de resultaten rapporteren (zonder een selectief antwoordmasker op de testprotocollen).
In België heeft het Nationaal Antibiogram Comité (NAC) recent aanbevelingen gepubliceerd omtrent de te testen antibiotica voor een standaard antibiogram voor de belangrijkste groepen van pathogene bacteriën, evenals suggesties voor de rapportage van de resultaten (inclusief MDRO). Deze aanbevelingen kunnen teruggevonden worden op de website van het NAC: https://www.bvikm.org/national-antimicrobial-committee-nl
De door het ECDC vastgestelde multiresistentiecriteria waren de volgende: multiresistentie (MDR; Multidrug resistant): resistentie tegen minstens één antimicrobiële agens binnen drie of meer antibioticaklassen; extensief resistent (XDR; extensively resistant): resistentie tegen minstens één agens in alle antibioticaklassen op één of twee na; en volledig resistent (PDR; Pandrug resistant): resistentie tegen alle antimicrobiële agentia in alle antibioticaklassen. Er zij op gewezen dat deze definities dateren van 2011 en gebaseerd waren op de klinische drempels die toen door de EUCAST waren vastgesteld. Dit omvatte zowel de zogenaamde intermediaire (I) als de resistente (R) stammen. Gezien de veranderingen binnen het EUCAST sinds 2020 is het belangrijk ervoor te zorgen dat laboratoria in de bovenstaande definities van MDRO’s nu alleen de resistentiecategorie (R) gebruiken en dat epidemiologische surveillancegegevens worden uitgedrukt in %R vs. %S+I. Dit moet ook gelden voor maatregelen ter voorkoming en bestrijding van de overdracht van MDRO’s, waarbij alleen de R-categorie (en niet R+I) in aanmerking moet worden genomen.
Deze voorstellen hebben alvast de verdienste dat ze bestaan, toch laten ze ruimte voor talrijke variaties en mogelijke interpretaties (bijv. passende keuze van de binnen een klasse geteste moleculen, ontbreken van prioriteitscriteria bij de keuze van antibioticaklassen naar gelang van hun klinisch belang (identiek gewicht), gebruik van het I+R-criterium, verschillen in de criteria die worden gehanteerd om een MDRO te kwalificeren naar gelang van het land. Zo is uit recente studies gebleken dat het gebruik van variabele definities van multiresistentie tot aanzienlijke wijzigingen kan leiden in het aantal multiresistente bacteriële isolaten en het percentage patiënten dat drager is van multiresistente bacteriën. Dit bleek vooral het geval te zijn bij Gram-negatieve bacteriën. Deze variaties vloeien voort uit de verschillen in de gehanteerde criteria, zowel wat betreft het aantal en de types antibioticaklassen die nodig zijn om aan de voorwaarden voor multiresistentie te voldoen, de antibiotica die (binnen een klasse) als relevant worden beschouwd, als het panel van geteste antibiotica. Een retrospectieve studie uitgevoerd door Wolfensberger et al. (Antimicrob Res Infect Control, 2019) in een Zwitsers universitair ziekenhuis over een periode van meer dan 3 jaar (2013-2015) heeft aangetoond dat afhankelijk van de toepassing van de in Duitsland gehanteerde criteria voor multiresistentie, of die van het ECDC of die welke plaatselijk in het universitair ziekenhuis van Zürich worden gebruikt (bij gebrek aan nationale aanbevelingen voor Zwitserland), er aanzienlijke verschillen in de percentages MDR gramnegatieve bacteriën konden worden vastgesteld (gemiddeld x3). Dit was met name het geval bij toepassing van de ECDC-criteria, die rekening houden met het aantal resistente antibioticaklassen (1 agens per 3 antibioticaklassen), in vergelijking met de Duitse criteria, die tot 4 klassen vereisen, en meer specifiek binnen de daarin beschouwde antibiotica. Zoals het er nu voorstaat, werd deze studie uitgevoerd in een epidemiologische context met een geringe resistentieprevalentie. Het is dan ook heel goed mogelijk dat het effect nog groter zou zijn op plaatsen met een hogere resistentieprevalentie. Er zij ook op gewezen dat in deze studie de EUCAST-interpretatiecriteria werden gebruikt vóór de wijzigingen in de interpretatie van de resultaatscategorie «I», die globaal werden geïnterpreteerd (I + R, niet-gevoelig). De impact van de EUCAST-wijzigingen op de interpretatie van categorie «I» in 2020 en de gevolgen daarvan voor IPC-voorzorgsmaatregelen zijn nog niet bekend en moeten worden geëvalueerd en opgevolgd.
Het is van belang dat de multiresistentiecriteria goed worden gekozen naar gelang de doelstellingen (epidemiologische surveillance vs. richtsnoeren voor infectiepreventie en -controlemaatregelen (IPC)) en de lokale resistentiecijfers, aangezien de definities die de IPC-voorzorgsmaatregelen bepalen rechtstreekse gevolgen hebben voor de kosten en de patiëntenzorg. We herinneren eraan dat in tabel 1 alle criteria staan opgesomd die worden gebruikt voor de definitie van Gram-negatieve multiresistente bacteriën (GN-MDRO) in België, volgens de aanbevelingen van de Hoge Gezondheidsraad (Advies nr. 9277, april 2019).
Behalve verschillen in de definitie van MDR hebben recente studies, uitgevoerd in het kader van transnationale Europese surveillancenetwerken in grensgebieden (Duitsland-Nederland, Duitsland-Zwitserland-Frankrijk), een zeer grote heterogeniteit aangetoond in de prevalentie van dragerschap van verschillende MDRO’s bij patiënten in naburige ziekenhuizen in dezelfde regio, maar vooral ook aanzienlijke verschillen in screeningprocedures en -protocollen (verschillen in de risicofactoren die voor screening in aanmerking worden genomen, verschillen in de lichaamssites waar de swabs worden genomen,..), alsook in de toegepaste IPC-maatregelen (persoonlijke beschermingsmiddelen, aanbevolen isolatiemaatregelen, …) om de verspreiding van MDRO’s te beperken.
Bovendien is uit deze studies gebleken dat ondanks het bestaan van nationale of lokale aanbevelingen, deze op velerlei wijzen werden geïnterpreteerd en vaak slecht werden toegepast (nalevingspercentages van minder dan 30% tot 60%, afhankelijk van de geanalyseerde criteria). Lokale audits en enquêtes die onder deskundigen worden uitgevoerd wijzen op het gebrek aan responsabilisering van de zorgverstrekkers bij de beslissing om screenings uit te voeren en op de behoefte aan een betere opleiding van de zorgverstrekkers op vlak van MDRO-screeningprotocollen. Het is duidelijk dat verschillen in screeningprotocollen de behandeling van patiënten in een transnationale context maar ook op regionaal niveau binnen hetzelfde land bemoeilijken. In dit verband bieden de actie van de gewestelijke platforms voor ziekenhuishygiëne in België en de oprichting van multidisciplinaire teams in het kader van de onlangs opgezette proefprojecten HOST, mogelijkheden om de samenwerking tussen ziekenhuizen op gewestelijk niveau te versterken en te optimaliseren. De complexe problematiek van de MDRO’s (standaardisatie van screeningsprotocollen, gemeenschappelijke signalisatie en overdrachtsdocumenten, programma voor permanente opleiding) is in dit verband zeker een ideaal toepassingsgebied.
De verwijzingen uit dit artikel en de samenvatting ervan zijn te vinden in de rubriek «Voor u gelezen» van dit nummer van NOSO-Info.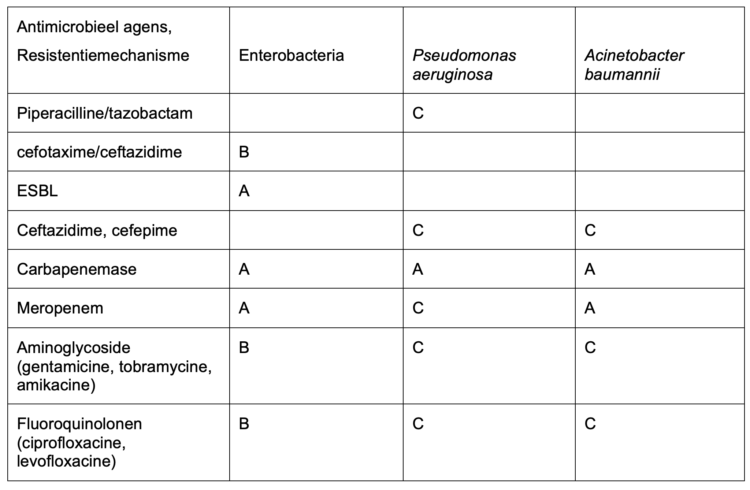
Tabel 1. Criteria gebruikt voor de definitie van Gram-negatieve multiresistente bacteriën (GN-MDRO) volgens de Belgische aanbevelingen (Hoge Gezondheidsraad, HGR Advies nr. 9277, april 2019)
A: ESBL + (alle soorten enterobacteriën, behalve E. coli), aanwezigheid van carbapenemase (Enterobacteria, Pseudomonas aeruginosa, Acinetobacter) of R op Meropenem (Enterobacteria, Acinetobacter) worden automatisch als MDRO beschouwd.
B: Enterobacteriën resistent tegen >1antibioticum in 3 antibiotica-klassen (cefalo 3G, aminoglycosiden, fluoroquinolonen)
C: Pseudomonas aeruginosa, Acinetobacter baumannii resistent tegen >1antibioticum in >3 antibioticaklassen (pipera/tazo, Cefalo 3G/4G, carbapenems, aminoglycosiden, fluoroquinolonen)
Voor de kwalificatie van GN-MDRO moeten alleen «R»-resultaten (resistent) in aanmerking worden genomen op basis van klinische kritieke punten overeenkomstig de bijgewerkte EUCAST-aanbevelingen (vanaf versie 10 of vanaf 2020) en niet zoals voorheen op basis van «niet-gevoelige» resultaten (I + R). In de huidige EUCAST-aanbevelingen worden de kritieke punten die categorie «I» definiëren geïnterpreteerd als ‘gevoelig bij hogere blootstelling’ (dosering/aantal doseringen/wijze van toediening).
Het aantal klassen en het aantal binnen een klasse geteste antibiotica moet voldoende zijn om stammen als MDRO te categoriseren.
In geval van onbeantwoorde resultaten (gemaskeerd antwoord) moeten de basisgegevens in het laboratorium beschikbaar zijn. Op basis van commerciële diagnostische tests die een aanvulling vormen op de standaard antibioticagevoeligheidstest die momenteel op de markt is (fenotypische, colorimetrische/biochemische, antigene, moleculaire tests), kunnen de belangrijke resistentiemechanismen van MDRO-NG’s op betrouwbare wijze worden opgespoord, zonder te wachten op bevestiging van het resultaat door een referentielaboratorium (CNR) om preventieve maatregelen te nemen (contactmaatregelen/isolatie in een eenpersoonskamer).
Nieuwigheden
Wetenschappelijke agenda
- maart 2024
-
28/03
BICS Symposium
- april 2024
-
van 8/04 tot 11/04 || in Edinburgh
The Microbiology Society Annual Conference
-
van 23/04 tot 24/04 || in Birmingham
Infection and Prevention Control (IPC)
-
van 27/04 tot 30/04 || in Barcelona
34th European Congress of Clinical Microbiology and infectious diseases
- mei 2024
-
van 16/05 tot 17/05 || in Louvain-La-Neuve
18ème Rencontre Internationale Francophone des Infirmiers et Infirmières (RIF)



