Een genomische epidemiologische analyse van een aanhoudende polyclonale NICU-uitbraak van Serratia marcescens in het GZA, Sint-Augustinus, Antwerpen
Dit artikel is een aanpassing voor noso-info van de originele versie, aanvaard in Eurosurveillance (Van Goethem S., et al. Genomic epidemiological analysis of a sustained single centre polyclonal outbreak of Serratia marcescens, 2022-2023, Antwerp, Belgium. EuroSurveillance. 2024)
Inleiding
Serratia marcescens maakt deel uit van de Enterobacterales, een familie van gramnegatieve bacillen, en is overal in het milieu terug te vinden, van de bodem tot vijvers over de ingewanden van dieren[1,2].Deze verscheidenheid aan omgevingen gaat gepaard met een hoge biologische diversiteit, wat in het verleden heeft geleid tot enige verwarring rond de pathogeniteit en het uitbraakpotentieel.[3] De eerste uitbraak werd gemeld in 1951, meer dan 120 jaar na de ontdekking ervan, maar hun belang bij ziekenhuisuitbraken werd pas duidelijk vanaf de jaren 1960.[4-8] Hoewel hun aanwezigheid in de darmen van zuigelingen al in 1957 werd opgemerkt en een eerste uitbraak bij pasgeborenen in 1966 werd gemeld, werd hun belang bij uitbraken op de NICU pas jaren later erkend.[9-11] In 2007 was het de op twee na meest voorkomende ziekteverwekker bij uitbraken op de NICU.[12] NICU-uitbraken met S. marcescens zijn moeilijk onder controle te krijgen en vereisen vroegtijdige detectie en snelle implementatie van strikte maatregelen voor infectiepreventie- en controle (IPC).[13] Hoewel meestal wordt aangenomen dat kruisoverdracht via de handen van zorgverleners de belangrijkste wijze van overdracht is, spelen waterbronnen (lavabo’s, airconditioning, enz.), vloeibare voeding (moedermelk, babyvoeding, totale parenterale voeding, enz.), zeep, ontsmettingsmiddelen en medicatie een rol bij Serratia-uitbraken.[14,15] Hoewel uitbraken met één duidelijke bron en een korte tijdspanne monoklonaal kunnen zijn, gaat het bij de meeste uitbraken om meerdere klonen, waarbij sommige clusters prominenter zijn dan andere. [16-27] In dit rapport beschrijven we een S. marcescens uitbraak op de NICU van het GZA Sint-Augustinus ziekenhuis (nu ZAS Augustinus) in Antwerpen.
Setting
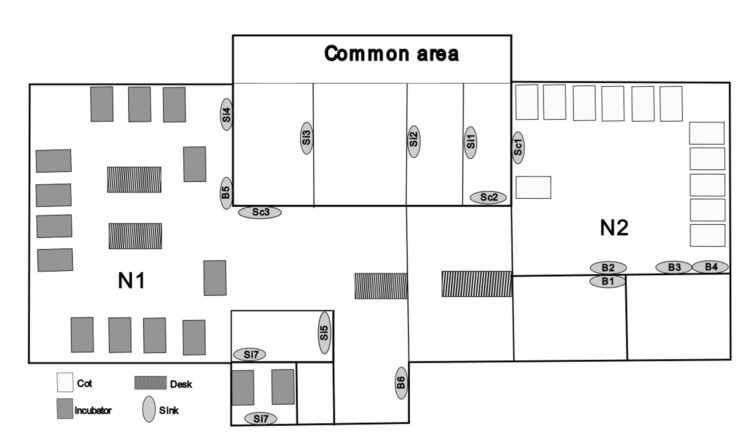
Het GZA Sint-Augustinusziekenhuis is een secundair ziekenhuis met 580 bedden. Het heeft het grootste zorgcentrum voor moederkindzorg van Antwerpen, met meer dan 5000 geboortes per jaar. De NICU (figuur 1) telt 27 bedden, verdeeld in twee verschillende zones: een zone voor intensive care (N1, 15 couveuses) en een zone voor medium care (N2, 12 kinderbedden). Er is één gedeelde zone die wordt gebruikt als ingang, bureau en opslagruimte en die verschillende lavabo’s bevat waar ouders en medisch personeel hun handen kunnen wassen voordat ze de NICU betreden. Personeel en medische apparatuur worden gedeeld tussen de twee zones.
Figuur 1. Schematische weergave van de plattegrond van de NICU in 2022. B: bad; Sc: scrub; Si: lavabo; N1: zone voor intensive care; N2: zone voor medium care.
Detectie van de uitbraak
Een eerste geval werd ontdekt op 28 februari 2022, toen een premature pasgeborene (deel van een tweeling) na 26 weken zwangerschap snel een fatale shock ontwikkelde, geassocieerd met S. marcescens-positieve bloedkweken. De aanwezigheid van S. marcescens in een conjunctivaal uitstrijkje van een andere pasgeborene in deze periode alarmeerde de behandelende neonatologen, die bij het labo informeerden naar eerdere aanwezigheden van de kiem binnen de afdeling. Uit onderzoek van het laboratorium bleek dat er tussen 31 januari en 1 maart 2022 nog vier positieve monsters van patiënten waren binnen dezelfde zone van de NICU (N1, intensive care). Daarentegen werd S. marcescens gedetecteerd bij slechts één pasgeborene die in 2021 op de NICU was opgenomen. Op 2 maart 2022 werd een uitbraak gemeld.
Onderzoek van de uitbraak
Een casus werd gedefinieerd als een pasgeborene die was opgenomen op de NICU en die gekoloniseerd of geïnfecteerd bleek te zijn met S. marcescens. De kolonisatie werd vastgesteld door wekelijks rectale swabs af te nemen bij alle opgenomen patiënten. Deze swabs werden uitgeplaat op een chromogene agar die specifiek is voor Serratia-soorten (Serratia Colorex, bioTRADING, Nederland) en verdachte kolonies werden geïdentificeerd met MALDI-TOF. Er werden monsters afgenomen van de afvoeren in de lavabo’s en badjes door de binnenkant en het resterende water in de afvoerbuis te swabben. Omgevingsmonsters werden geanalyseerd zoals de hierboven beschreven rectale monsters. Klinische monsters werden geanalyseerd volgens standaard bacteriologische procedures. Vatbaarheidstests werden uitgevoerd met disk diffusie volgens de EUCAST-criteria.
Moleculaire analyse werd uitgevoerd door middel van Whole Genome Sequencing (WGS) op alle beschikbare patiënt- en milieu-gerelateerde S. marcescens-isolaten (n = 64) met behulp van MiSeq (V2 500 cycli, Illumina Inc., CA, USA). Verwantschap werd beoordeeld door middel van whole genome Multi-Locus Sequencing Typing (wgMLST) en core genome Single Nucleotide Polymorphisms (cgSNP).
Onderzoek van de NICU-omgeving
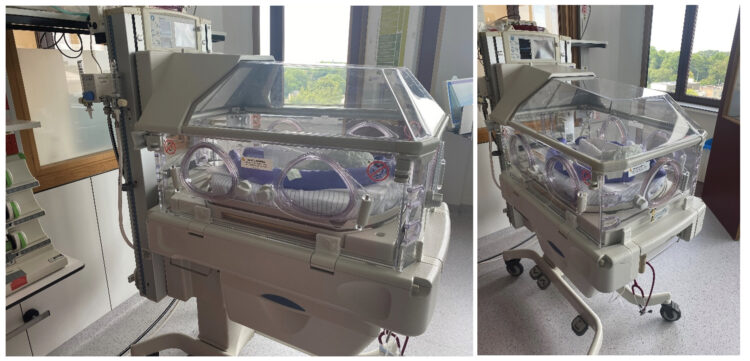
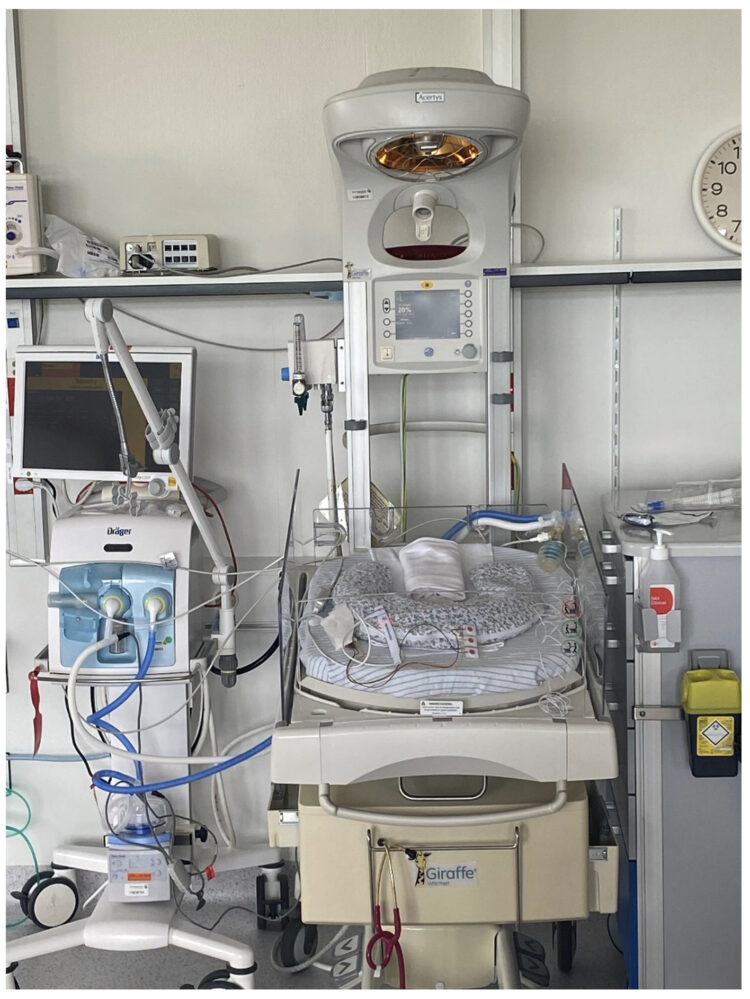
Bij het begin van de uitbraak op 2 maart 2022 werden omgevingsmonsters afgenomen van lavabo’s, voedingssondes, toetsenborden, waterkranen, buitenoppervlakken en waterreservoir van neonatale couveuses (figuur 2), luierweegschalen, borstpompen, oogdruppels, vloeibare zeep, parenterale voeding en bereide flessenmelk. Gezien de complexiteit van de NICU-zorg (zie figuur 3) was het nodig om de meest waarschijnlijke omgevingen te selecteren, afhankelijk van de gevonden ziekteverwekker (in dit geval voornamelijk waterige en vochtige omgevingen). Behalve op het oppervlak van de couveuse van de overleden pasgeborene, werd S. marcescens alleen aangetroffen in swabs van verschillende afvoeren van lavabo’s en badjes. Na deze resultaten werden de lavabo’s 2 tot 3 keer per week gecontroleerd (afhankelijk van de positiviteit) en werd gestart met een ontsmettingsprotocol voor afvoeren met 9,9% azijnzuur. Vergelijkbare omgevingsmonsters werden afgenomen op 15 december 2022, toen zich een nieuwe piek van gevallen voordeed. De afvoeren bleven de enige omgevingsbron die S. marcescens-stammen bevatte.
Figuur 2: Incubator die de temperatuur en vochtigheid regelt in een gesloten systeem. Foto’s van GZA St. Augustinus (nu ZAS Augustinus).
Figuur 3. Uitgeruste Giraffe Warmer, ter illustratie van de uitdaging bij het selecteren van monsters tijdens het omgevingsonderzoek. Foto van GZA St. Augustinus (nu ZAS Augustinus).
Controlemaatregelen uitbraak
Er werd een multidisciplinair uitbraakcontroleteam samengesteld, bestaande uit de afdelingshoofden (arts en verpleegkundige), een microbioloog, een lid van het Hospital Outbreak Support Team (HOST), een specialist in kinderinfectieziekten, specialisten in infectiecontrole- en -preventie en een vertegenwoordiger van de raad van bestuur van het ziekenhuis. Bijhet begin van de uitbraak werd beslist om de afdeling niet te sluiten, maar om nieuwe opnames te beperken, contactvoorzorgsmaatregelen te nemen en te beginnen met systematische rectale screening van pasgeborenen op de afdeling. Er werd toegewezen verplegend personeel aangesteld en er werd begonnen met cohortering van de getroffen pasgeborenen. Schoonmaak- en desinfectiepraktijken op de afdeling werden versterkt door gespecialiseerd personeel in te zetten. Tijdens de eerste week van de uitbraak is het uitbraakcontroleteam dagelijks ter plaatse gekomen om mogelijke uitbraakbronnen en transmissieroutes te onderzoeken. Tijdens de eerste vergadering van het uitbraakcontroleteam werden maatregelen voor uitbraakbestrijding vastgesteld. Vervolgens werd de situatie opnieuw geëvalueerd tijdens de wekelijkse teamvergaderingen. De beperking van de opnames werd op 31 maart opgeheven nadat een casusvrij interval van 2 weken was waargenomen en de meeste gevallen van de afdeling waren ontslagen. De maatregelen werden beëindigd op 22 november 2022, bijna 9 maanden na het begin van de uitbraak. Er werd beslist om alert te blijven voor nieuwe gevallen en de maatregelen opnieuw in te stellen bij vaststelling van een nieuw klinisch geval. Dit gebeurde op 15 december 2022 en de eerder toegepaste maatregelen voor uitbraakbestrijding werden opnieuw ingevoerd, met uitzondering van de beperking van opnames op de afdeling. Die werd niet opnieuw ingevoerd vanwege de grote impact op de activiteiten in de materniteit van het ziekenhuis. Er werd ook beslist om de uitbraakmaatregelen te beëindigen na een casusvrij interval van 2 weken. Deze drempel werd bereikt op 13 maart 2023, maar 4 maanden later, op 29 juni 2023, moesten opnieuw maatregelen worden ingevoerd omdat er nieuwe gevallen werden ontdekt aan de hand van klinische monsters. Met de reactivering van de uitbraakmaatregelen werd ook een nieuw protocol voor de desinfectie van couveuses ingevoerd, waarbij de couveuse van een ontslagen pasgeborene na reiniging eerst werd gedesinfecteerd met vernevelde waterstofperoxide, alvorens die opnieuw in gebruik te nemen voor een nieuwe opname. Alle uitbraakmaatregelen werden op 29 augustus 2023 beëindigd, inclusief rectale screening en de systematische screening van de afvoeren. Sindsdien moesten geen uitbraakmaatregelen meer worden ingevoerd.
Overzicht van casussen en genomische epidemiologische analyse
Vanaf de eerste casus op 28 februari 2022 tot 29 augustus 2023 werden in totaal 58 casussen geïdentificeerd. Een epicurve van de hele uitbraakperiode is weergegeven in figuur 1 (bovenste gedeelte), waarin ook de bedbezetting van de afdeling is weergegeven (stippellijn). Hogere incidentiepieken worden waargenomen tijdens perioden van verhoogde bedbezetting. Figuur 1 bevat ook een tijdlijn voor elke individuele casus (middelste gedeelte) en positieve monsters van verschillende afvoeren (onderste gedeelte).
Figuur 4. Overzicht van wekelijkse casussen in de NICU-zones N1 (intensive care) en N2 (medium care). Begin en einde van het ziekenhuisverblijf van alle geïdentificeerde casussen zijn beschreven (P1-P61). P1, P2 en P4 werden retrospectief aangetroffen. De epicurve verwijst naar het aantal S. marcescens-positieve patiënten in de afdeling en het clustertype van de S. marcescens-stam. Tijdstip van sequentiebepaling en begin en einde van de uitbraakmaatregelen (rode vakken) zijn aangeduid. De totale bezetting in de afdeling wordt weergegeven door een stippellijn op de epicurve. Op de tijdlijn van de ziekenhuisopname wordt het verblijf op de NICU aangeduid met horizontale lijnen, waarbij verschillende kleurmarkeringen verwijzen naar de S. marcescens-stammencluster. Omgevingsmonsters zijn bruin weergegeven (Si1-5: lavabo-afvoeren; Sc1-3: scrubafvoeren; B1-6: badafvoeren). De eerste casus met sepsis is aangeduid (‘Sepsis’), C1-C8: Clusters 1-8; S1-S5: Singletons 1-5; UNK: onbekend S. marcescens clustertype (stam niet gesequenced); CLIN: S. marcescens-positief klinisch monster; RS: S. marcescens-positief rectaal screeningsmonster; Scr: S. marcescens-positief omgevingsscreeningmonster; X: overleden; N1: intensive care; N2: medium care; C: Gemeenschappelijke NICU-ruimte tussen N1 en N2.
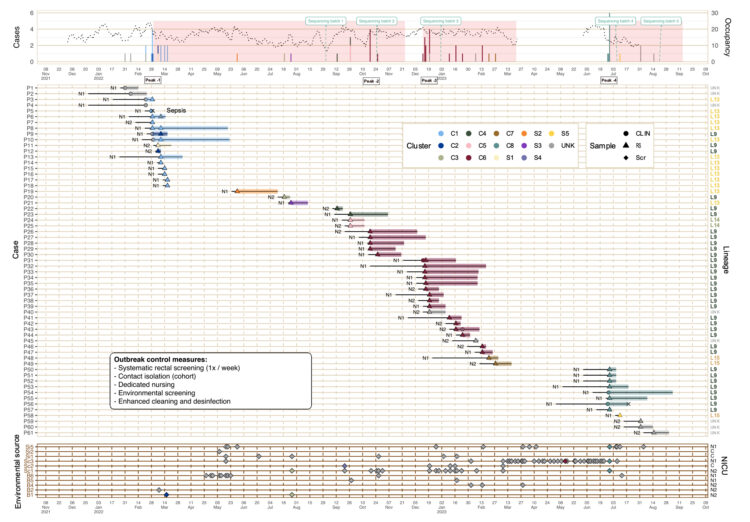
In totaal hadden 10 pasgeborenen een klinische infectie door S. marcescens, waaronder infecties van de lagere luchtwegen (n=5: P3, P10, P31, P54 en P56), acute conjunctivitis (n=4: P2, P4, P9 en P43), en bloedstroominfectie (n=1: P5). Alle stammen hadden een wild-type antibioticagevoeligheidspatroon (geen verworven resistentie). Eén kathetertip was positief voor S. marcescens (P1), maar werd niet in verband gebracht met infectie. Tijdens piekperioden varieerden de aanvalspercentages tussen 37 en 50%.
Het genoomonderzoek toonde meerdere niet-verwante klonen (polyklonaliteit). Klonen werden gegroepeerd in clusters (als > 1 stam met klonale verwantschap) of singletons (losse klonen, niet verwant aan andere geanalyseerde stammen), wat te zien is in figuur 5, die de wgMLST weergeeft. Alle stammen werden gerelateerd aan referentiestammen om hun fylogenetische afstamming te identificeren (afstamming 9 – afstamming 15).
Figuur 5. Clusters en singletons (n=64 isolaten) zijn gegroepeerd op basis van de afstand tot andere stammen. Het benoemen van clusters gebeurde in volgorde van isolatie in de tijd. Getallen vertegenwoordigen afstanden in allel loci van een totaal van 5033 geïdentificeerde loci. Clusters worden samengevoegd tot taartdiagrammen wanneer minder dan 12 van de 5033 loci verschillend waren. L9-L15: Fylogenetische afstamming 9 – 15, volgens Williams et al. [1]
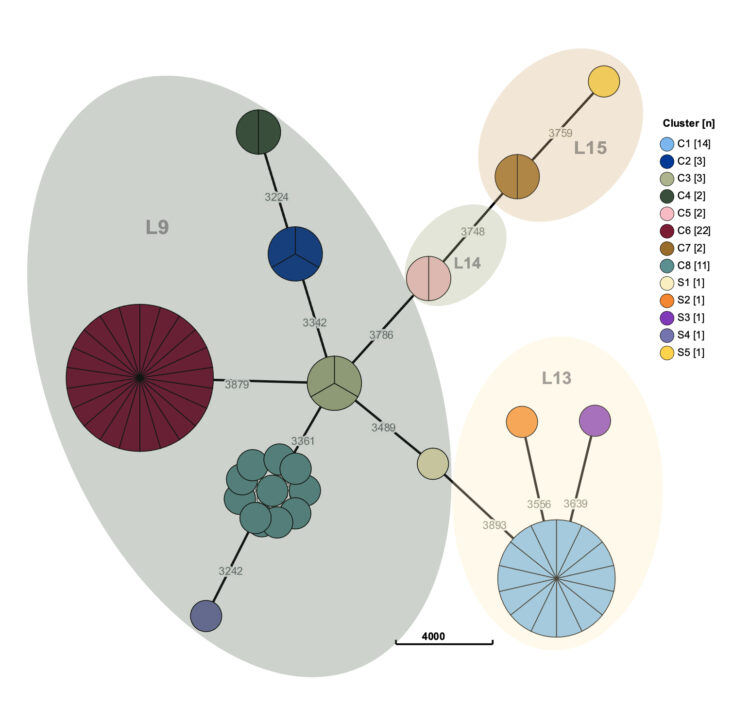
Een overzicht in de tijd van de verschillende clusters wordt ook weergegeven in Figuur 4 (kleuren van de positieve monsters). Er kunnen drie grotere clusters geïdentificeerd worden (C1, C6 en C8), die elk met enkele maanden tussentijd voorkomen en genetisch niet met elkaar verwant zijn.
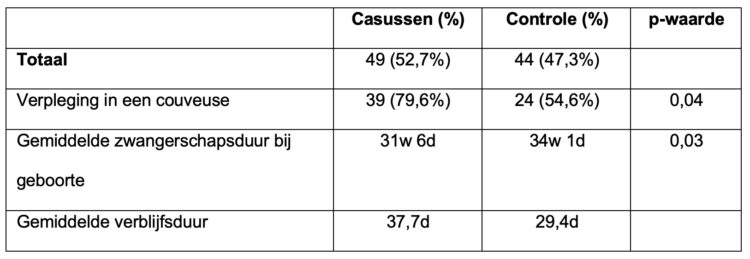
Tijdens periodes met grotere klonale clusters werden de meeste casussen verzorgd op de intensive care van de NICU (N1), waar alle patiënten in couveuses worden ondergebracht/bewaakt. Tussen 1 maart 2022 en 1 januari 2023 werd een case-controlstudie uitgevoerd. Zowel verzorging in een couveuse als een lagere zwangerschapsduur bij de geboorte bleken geassocieerd te zijn met de verwerving van S. marcescens tijdens de ziekenhuisopname (p < 0,05).
Tabel 1. Case-controleanalyse van S. marcescens-positieve gevallen van 1 maart 2022 tot 1 januari 2023 en een controlegroep bestaande uit S. marcescens-negatieve patiënten die waren opgenomen in het ziekenhuis tijdens perioden met een hogere incidentie van casussen: 1 – 17 maart 2022, 8 – 23 oktober 2022 en 13 – 28 december 2022. De zwangerschapsduur bij de geboorte wordt weergegeven als het aantal weken (w) en dagen (d). P-waarden zijn het resultaat van een multivariabele logistische regressie met Serratia marcescens positiviteit als dichotome uitkomst. Lengte van verblijf werd uitgesloten van de regressie-analyse omdat de berekende tolerantie < 0,6 was.
S. marcescens gevonden in afvoerbuizen
S. marcescens werd geïsoleerd uit 11 van de 16 afvoeren die op de afdeling aanwezig waren (N1: 4/7, N2: 4/5, gemeenschappelijke ruimte: 3/4). Als we kijken naar de positiviteit per week, was de positiviteitsratio van alle gescreende afvoeren 5,8%. Sequentie-analyse van stammen gekweekt uit afvoeren toonde gelijktijdige aanwezigheid van S. marcescens stammen bij zowel patiënten als afvoeren gedurende hetzelfde tijdsbestek in 4 van de 5 clonale clusters: C2 op 15 maart 2022, C3 op 27 juli 2022, C6 op 13 mei 2023 en C8 op 29 juni 2023 (Figuur 1). Eén stam werd uitsluitend gedetecteerd in de afvoer van Scrub 2 (S4 op 21 september 2022). Stam Sc3a, gevonden in de afvoer van Scrub 3, bleef nog 2 maanden aanwezig na het vertrek van de laatste S. marcescens-positieve patiënt met een stam uit deze klonale cluster (C6 op 13 mei 2023, figuur 1). Alle stammen die in afvoeren werden aangetroffen, behoorden tot de fylogenetische stam 9, de belangrijkste ziekenhuisgerelateerde afstamming.
Op 1 maart 2023 werden 4 verwarmde afvoeren geïnstalleerd (Scrub 1, 2 en 3 en lavabo 5). Deze afvoeren hebben een éénmaal daags thermisch desinfectieprotocol waarbij de afvoer gedurende 5-6 cycli tot 85°C wordt verhit. De afvoer van Scrub 3 vertoonde een opvallend hoog aantal herhaaldelijk positieve screeningsmonsters na een onjuiste installatie van de verwarmde afvoer. Uit voorzorg werden alle vier verwarmde afvoeren op 18 juli 2023 verwijderd.
Bespreking en conclusies
Aangezien S. marcescens een alomtegenwoordig organisme is, valt te verwachten dat ze op verschillende manieren op de NICU binnenkomen, waaronder via handen van zorgverleners en ouders, waterbronnen, medische apparatuur, ventilatiesystemen, enz. Bij een uitbraak van Enterobacter spp. in de NICU is beschreven dat couveuses ook ééen van de factoren kunnen zijn die bijdragen tot het ontstaan van de uitbraak.[28] Hoewel wij ook een correlatie vonden tussen verwerving van S. marcescens en verpleging in een couveuse, geloven wij niet dat dit de primaire bron van de uitbraak was, maar eerder een facilitator voor snelle transmissie, aangezien de afgelopen jaren geen wijzigingen werden aangebracht in de procedures met betrekking tot de omgang met couveuses. De opstelling van alle couveuses in N1 en kinderbedden in N2 beperkt onze mogelijkheden om effectief een direct oorzakelijk verband vast te stellen tussen verzorging in een couveuse en kolonisatie met S. marcescens. Casussen van kolonisatie met S. marcescens werden in N2 ook waargenomen in dezelfde clusters als in N1, zowel bij patiënten als in afvoeren, maar zonder een uitgebreide verspreiding zoals in N1. Een mogelijke vertekening kan ontstaan door de correlatie tussen pasgeborenen met een lagere zwangerschapsduur en verzorging in een couveuse. Ook konden we het gebruik van invasieve procedures niet uitsluiten als de echte risicofactoren voor kolonisatie.[29]
Met behulp van genoomsequentieanalyse konden verschillende clusters van S. marcescens worden geïdentificeerd. De meeste van de gesequencede S. marcescens stammen gevonden bij patiënten en alle stammen afkomstig uit de omgeving behoorden tot de fylogenetische lijn 9, die de belangrijkste menselijke, ziekenhuisgeassocieerde lijn is. Hoewel we het initiële reservoir voor de uitbraak niet konden identificeren, werden stammen gevonden in watermonsters uit afvoeren, die, zelfs als ze niet het primaire reservoir zijn, kunnen dienen als secundair reservoir waarin stammen enkele maanden kunnen overleven, zoals we hebben gezien met een stam van C6 in Scrub 3. Deze uitbraak en bewijs uit andere recente studies pleiten voor het verwijderen van afvoeren uit de kamers van NICU-patiënten en voor ‘watervrije’ zorg voor pasgeborenen, wat de kolonisatiegraad van NICU-patiënten met Gram-negatieve bacteriën zoals S. marcescens zou kunnen verminderen. [30]
Aangezien meer ziekenhuizen in België recentelijk gelijkaardige S. marcescens uitbraken in NICU’s hebben gerapporteerd, gepubliceerd en ongepubliceerd, zou het raadzaam kunnen zijn om in België een nieuw gestructureerd surveillancesysteem op te starten op nationaal niveau, dat vroeger bestond als onderdeel van Neo-KISS, maar waarvan de laatste surveillanceperiode in 2011 was.[31,32].
Referenties
1. Williams DJ, Grimont PAD, Cazares A, Grimont F, Ageron E, Pettigrew KA, et al. The genus Serratia revisited by genomics. Nat Commun. 2022 Dec 1;13(1).
2. Grimont PAD, Grimont F. The Genus Serratia. Annu Rev Microbiol [Internet]. 1978 Oct ;32(1):221–48. Disponible sur : www.annualreviews.org
3. Mahlen SD. Serratia infections : From military experiments to current practice. Vol. 24, Clinical Microbiology Reviews. 2011. p. 755–91.
4. WHEAT RP. INFECTION DUE TO CHROMOBACTERIA. AMA Arch Intern Med [Internet]. 1951 Oct 1 ;88(4):461. Disponible sur : http://archinte.jamanetwork.com/article.aspx?doi=10.1001/archinte.1951.03810100045004
5. TAYLOR G, KEANE PM. Cross-infection with Serratia marcescens. J Clin Pathol. 1962 ;15(November 1960):145–7.
6. LANCASTER LJ. Role of Serratia Species in Urinary Tract Infections. Arch Intern Med [Internet]. 1962 May 1 ;109(5):536. Disponible sur : http://archinte.jamanetwork.com/article.aspx?doi=10.1001/archinte.1962.03620170034005
7. Clayton E. Nonpigmented Serratia marcescens. JAMA: The Journal of the American Medical Association [Internet]. 1966 Sep 26 ;197(13):1059. Disponible sur : http://jama.jamanetwork.com/article.aspx?doi=10.1001/jama.1966.03110130059015
8. Cabrera HA. An outbreak of Serratia marcescens, and its control. Arch Intern Med [Internet]. 1969 Jun;123(6):650–5. Disponible sur : http://www.ncbi.nlm.nih.gov/pubmed/4890440
9. WAISMAN HA, STONE WH. The presence of Serratia marcescens as the predominating organism in the intestinal tract of the newborn; the occurrence of the red diaper syndrome. Pediatrics [Internet]. 1958 Jan ;21(1):8–12. Disponible sur : http://www.ncbi.nlm.nih.gov/pubmed/13494071
10. McCormack RC, Kunin CM. Control of a single source nursery epidemic due to Serratia marcescens. Pediatrics [Internet]. 1966 May ;37(5):750–5. Disponible sur : https://pubmed.ncbi.nlm.nih.gov/5326773/
11. Stamm WE, Kolff CA, Dones EM, Javariz R, Anderson RL, Farmer JJ, et al. A nursery outbreak caused by Serratia marcescens—scalp-vein needles as a portal of entry. J Pediatr [Internet]. 1976 Jul;89(1):96–9. Disponible sur : www.nejm.org
12. Gastmeier P, Loui A, Stamm-Balderjahn S, Hansen S, Zuschneid I, Sohr D, et al. Outbreaks in neonatal intensive care units-They are not like others. Am J Infect Control. 2007 Apr;35(3):172–6.
13. Gastmeier P. Serratia marcescens : An outbreak experience. Vol. 5, Frontiers in Microbiology. Frontiers Media S.A. ; 2014.
14. Cristina ML, Sartini M, Spagnolo AM. Serratia marcescens infections in neonatal intensive care units (NICUs). Vol. 16, International Journal of Environmental Research and Public Health. MDPI AG ; 2019.
15. Smith PJ, Brookfield DSK, Shaw DA, Gray J. AN OUTBREAK OF SERRATIA MARCESCENS INFECTION IN A NEONATAL UNIT. The Lancet [Internet]. 1984 Jan ;323(8369):151–3. Disponible sur : https://linkinghub.elsevier.com/retrieve/pii/S0140673684900746
16. Martineau C, Li X, Lalancette C, Perreault T, Fournier E, Tremblay J, et al. Serratia marcescens outbreak in a neonatal intensive care unit: New insights from next-generation sequencing applications. J Clin Microbiol. 2018 Sep 1 ;56(9).
17. Hayashi W, Yoshida S, Izumi K, Koide S, Soga E, Takizawa S, et al. Genomic characterisation and epidemiology of nosocomial Serratia marcescens isolates resistant to ceftazidime and their plasmids mediating rare blaTEM-61. J Glob Antimicrob Resist. 2021 Jun 1;25:124–31.
18. Friedrich R, Rappold E, Bogdan C, Held J. Comparative analysis of the wako Β-glucan test and the fungitell assay for diagnosis of candidemia and Pneumocystis jirovecii pneumonia. J Clin Microbiol. 2018 Sep 1 ;56(9).
19. Escribano E, Saralegui C, Moles L, Montes MT, Alba C, Alarcón T, et al. Influence of a Serratia marcescens outbreak on the gut microbiota establishment process in low-weight preterm neonates. PLoS One. 2019 May 1 ;14(5).
20. Kim EJ, Park WB, Yoon JK, Cho WS, Kim SJ, Oh YR, et al. Outbreak investigation of Serratia marcescens neurosurgical site infections associated with a contaminated shaving razors. Antimicrob Resist Infect Control. 2020 May 12 ;9(1).
21. Géry A, Mouet A, Gravey F, Fines-Guyon M, Guerin F, Ethuin F, et al. Investigation of Serratia marcescens surgical site infection outbreak associated with peroperative ultrasonography probe. Journal of Hospital Infection. 2021 May 1 ;111:184–8.
22. Nakanishi N, Komatsu S, Iwamoto T, Nomoto R. Characterization of a novel plasmid in Serratia marcescens harbouring blaGES-5 isolated from a nosocomial outbreak in Japan. Journal of Hospital Infection. 2022 Mar 1;121:128–31.
23. Rödel J, Mellmann A, Stein C, Alexi M, Kipp F, Edel B, et al. Use of MALDI-TOF mass spectrometry to detect nosocomial outbreaks of Serratia marcescens and Citrobacter freundii. European Journal of Clinical Microbiology and Infectious Diseases. 2019 Mar 4;38(3):581–91.
24. Liu X, Yan Z, Ye L, Wang K, Li J, Lin Y, et al. Genomic epidemiological investigation of an outbreak of Serratia marcescens neurosurgical site infections associated with contaminated haircutting toolkits in a hospital barber shop. Journal of Hospital Infection. 2023 Dec 1;142:58–66.
25. Rohit A, Suresh Kumar D, Dhinakaran I, Joy J, Kumar DV, Ballamoole KK, et al. Whole-genome-based analysis reveals multiclone Serratia marcescens outbreaks in a non-neonatal intensive care unit setting in a tertiary care hospital in India. J Med Microbiol. 2019 Apr 1;68(4):616–21.
26. Yeo KT, Octavia S, Lim K, Lin C, Lin R, Thoon KC, et al. Serratia marcescens in the neonatal intensive care unit: A cluster investigation using molecular methods. J Infect Public Health. 2020 Jul 1;13(7):1006–11.
27. Dahdouh E, Lázaro-Perona F, Ruiz-Carrascoso G, García LS, de Pipaón MS, Mingorance J. Intestinal dominance by serratia marcescens and serratia ureilytica among neonates in the setting of an outbreak. Microorganisms. 2021 Nov 1;9(11).
28. Hernandez-Alonso E, Bourgeois-Nicolaos N, Lepainteur M, Derouin V, Barreault S, Waalkes A, et al. Contaminated Incubators: Source of a Multispecies Enterobacter Outbreak of Neonatal Sepsis. Microbiol Spectr. 2022 Aug 31;10(4).
29. Johnson A, Watson D, Dreyfus J, Heaton P, Lampland A, Spaulding AB. Epidemiology of Serratia Bloodstream Infections among Hospitalized Children in the United States, 2009-2016. Pediatric Infectious Disease Journal. 2020;E71–3.
30. Hopman J, Tostmann A, Wertheim H, Bos M, Kolwijck E, Akkermans R, et al. Reduced rate of intensive care unit acquired gram-negative bacilli after removal of sinks and introduction of “water-free” patient care. Antimicrob Resist Infect Control. 2017 Jun 10;6(1).
31. Muyldermans A, Crombé F, Bosmans P, Cools F, Piérard D, Wybo I. Serratia marcescens outbreak in a neonatal intensive care unit and the potential of whole-genome sequencing. Journal of Hospital Infection [Internet]. 2021 May ;111:148–54. Disponible sur : https://linkinghub.elsevier.com/retrieve/pii/S019567012100061X
32. Mahieu L ; Cossey V ; Mertens K ; Haumont D ; Naulaers G ; Quoilin S. https://www.sciensano.be/en/biblio/national-surveillance-nosocomial-infections-neonatal-intensive-care-units-belgium-neo-kiss
Nieuwigheden
Wetenschappelijke agenda
- oktober 2024
-
van 16/10 tot 20/10 || in Los Angeles
SHEA ID week. A joint meeting of IDSA, SHEA, HIVMA, PIDS and SIDP
- november 2024
-
van 20/11 tot 22/11 || in Liverpool
Healthcare infection society
- april 2025
-
van 11/04 tot 15/04 || in Wenen
Congrès de l’ European Society of Clinical Microbiology and Infectious Diseases (ESCMID)
- juni 2025
-
van 4/06 tot 6/06 || in Marseille
35ème Congrès National de la Société Française d’Hygiène Hospitalière (SF2H)
-
van 17/06 tot 18/06 || in Londen
HIS congres (Healthcare Infection Society)



