Bijdrage tot de beheersing van kathetersepsis : microbiologische aspecten
Voorwoord
Dit origineel artikel is gebaseerd op een deel van de gegevens die zijn voorgesteld in het kader van een doctoraatsthesis in medische wetenschappen verdedigd op 28/11/2014 aan de ’Université Libre de Bruxelles’, met als titel “Bijdrage tot de beheersing van de kathetersepsis met Staphylococcus epidermidis” (promotor: Pr Baudouin Byl, co-promotor:
Pr Marie Hallin).
Inleiding
Deze studie leert ons meer over S. epidermidis, zoals het bestaan van zowel multiresistente als virulente klonen die bijzonder goed zijn aangepast aan een ziekenhuisomgeving, over de mogelijke impact van de extra- en endoluminale besmettingsweg op de besmettingstermijnen en op de aard van de betrokken S. epidermidis, en over de mogelijke bijdrage van de zorgverstrekkers aan het ontstaan van CLABSI (kathetergeassocieerde septicemie).
Inleiding
De CLABSI is een frequente, ernstige en grotendeels vermijdbare zorginfectie, waardoor ze wordt voorgesteld als indicator voor de kwaliteit van zorg.
S. epidermidis is een commensale kiem die een belangrijke ziekteverwekker kan zijn van talrijke zorginfecties, zoals kathetersepticemieën. Deze CLABSIs zijn de belangrijkste oorzaak van infecties op intensieve zorgen en leiden tot een hoge morbiditeit, een langere verblijfsduur en meer kosten (Tacconelli et al., 2009). Tal van zowel fysiopathologische (zoals de vorming van een biofilm en de multiresistentie aan antibiotica) als epidemiologische (zoals de studies die de efficiëntie aantonen van preventiemaatregelen op de incidentie van kathetersepticemieën) argumenten onderstrepen het belang van de nood aan een betere kennis over de elementen die typisch zijn voor de pathogeniciteit van S. epidermidis en aan nieuwe preventiestrategieën.
In een eerste studie over de therapie en prognose van septicemieën op TIVAD (Totally implantable venous access device) hebben we vastgesteld dat in geval van S. epidermidis infecties, het klinische beeld heel variabel is. Toch werden enkel de aanwezigheid van een sepsis bij aanvang en lokale infectietekenen statistisch geassocieerd met een risico op mislukking van de therapeutische optie om de ingeplante TIVAD te behouden, terwijl dit niet het geval was voor de infectietermijn, de TIVAD insteekplaats, het type gebruik ervan en, bepaalde kenmerken van de patiënt (Cherifi et al., 2007). Dit wijst erop dat fenotypische microbiologische (antibiotica-resistentie) en/of genotypische (virulentiefactoren, genetische lijn) kenmerken van S. epidermidis mogelijks een belangrijke rol spelen in de pathogenese van kathetersepsis. De gegevens die tot op heden beschikbaar zijn op vlak van moleculaire epidemiologie, zowel wat de stammen van S. epidermidis in de gemeenschap als de ziekenhuisstammen in België betreft, zijn overigens beperkt of afkomstig van studies uit de dierengeneeskunde (Deplano et al., 1997; Piessens et al., 2011; Vanderhaeghen et al., 2012).
We hebben verschillende subpopulaties van S. epidermidis bestudeerd: commensale stammen van gezonde vrijwilligers, stammen die de handen van zorgverstrekkers koloniseren en stammen die verantwoordelijk zijn voor CLABSI. De idee was om een bijdrage te leveren aan de identificatie van eventuele fenotypische en genotypische kenmerken die eigen zijn aan S. epidermidis die CLABSI veroorzaken, en deze gegevens bovendien te koppelen aan klinische gegevens over de ernst van het klinische beeld.
Selectie van de stammen
In totaal werden 128 stammen van S. epidermidis bestudeerd.
Drieënvijftig klinische S. epidermidis-stammen uit de stammenbank van het laboratorium voor microbiologie van het Erasmusziekenhuis zijn afkomstig van patiënten die in datzelfde ziekenhuis zijn gehospitaliseerd. Deze patiënten zijn retrospectief in de databank van de ‘Clinique d’Epidémiologie et d’Hygiène Hospitalière’ geïdentificeerd omdat ze tussen 2006 en 2012 een CLABSI hebben opgelopen (n = 33 in de periode 2006-2011 en n = 20 in de periode 2011-2012).
In 2011 werden bij gezonde vrijwilligers, prospectief 33 commensale S. epidermidis-stammen verzameld door middel van een huiduitstrijkje onderaan de nek. Die vrijwilligers betroffen studenten in hun eerste jaar bachelor geneeskunde aan de ULB, die geen recent contact hadden gehad met een ziekenhuisomgeving en die tijdens de 3 maanden vóór de monstername geen antibiotica hadden genomen.
Tenslotte werden in 2012, via vingerafdrukken van de dominante hand, ook prospectief 42 S. epidermidis-stammen verzameld van het verpleegkundig personeel van het Erasmusziekenhuis in de tien hospitalisatie-eenheden waar het aantal gerapporteerde CLABSIs het hoogst was (vooral de departementen intensieve zorgen en gastro-enterologie).
Resultaten
Alle resultaten staan in de originele artikels, waarvan u hieronder een samenvatting kan vinden
Cherifi S, Byl B, Deplano A, Nonhoff C, Denis O, Hallin M.
Comparative epidemiology of Staphylococcus epidermidis isolates from patients with catheter-related bacteremia and from healthy volunteers.
J Clin Microbiol. 2013 May;51(5):1541-7
We hebben vastgesteld dat de S. epidermidis, die aan de basis liggen van de kathetersepticemieën (CLABSI), veel resistenter zijn tegen alle geteste antibiotica dan die van de gezonde vrijwilligers, en vooral dan tegen meticilline, erythromycine, ciprofloxacine en trimethoprim/sulfamethoxazole. De mec chromosoomcassette van de stafylokok type IV is de meest frequent voorkomende (27%), gevolgd door de mec chromosoomcassette van de stafylokok type III (15%).
De maturatie van de biofilm impliceert bij S. epidermidis PIA-productie (intercellular polysaccharide adhesin), die verantwoordelijk is voor het contact tussen bacteriën en voor de accumulatie van biofilm. De synthese van deze polysaccharide hangt af van de expressie van het ica (intercellular adhesin) chromosomaal operon.
Het ica-operon is vaker aanwezig bij de ziekenhuisstammen dan bij de stammen die gezonde vrijwilligers koloniseren (p<0.05).
Het ACME (arginine catabolic mobile element) wordt aangetroffen bij 76% van de stammen, ongeacht hun herkomst.
De S. epidermidis afkomstig van deze beide populaties zijn zeer gevarieerd en genetisch verschillend met slechts 23% gemeenschappelijke pulsotypes (zie Figuur 1). Die S. epidermidis zijn wel gedeeltelijk verbonden op fylogenetisch vlak, met 5 MLST op 12 die zijn geïdentificeerd als behorend tot hetzelfde klonaal complex CC7.
Een derde van de patiënten vertoonde een ernstig klinisch beeld. De meeste van deze patiënten waren de afgelopen 3 maanden gehospitaliseerd, hadden de maand daarvoor allen antibiotica gekregen (p<0.05) en de periode tussen hun opname en de sepsisepisode was langer (p<0.05), in vergelijking met patiënten met een niet zo ernstig klinisch beeld.
We hebben vastgesteld dat twee verwante genotypes (ST2 en SLV (single locus variant) ST54), ica positief, mec positief en multiresistent tegen antibiotica, enkel worden aangetroffen in de groep van S. epidermidis die verantwoordelijk is voor CLABSI en dat die bovendien worden geassocieerd met de meest ernstige klinische beelden.
Soraya Cherifi, Baudouin Byl, Ariane Deplano, Carole Nagant, Claire Nonhoff, Olivier Denis, and Marie Hallin
Genetic characteristics and antimicrobial resistance of Staphylococcus epidermidis isolated from patients with catheter-related bloodstream infections and from colonized healthcare workers in a Belgian hospital.
Annals of Clinical Microbiology and Antimicrobials. 2014 Jun 4 ;13(1) :20
Toen we op zoek waren naar een ziekenhuisreservoir van S. epidermidis hebben we de flora op de handen van de zorgverstrekkers vergeleken met de S. epidermidis-stammen die verantwoordelijk zijn voor CLABSI tijdens eenzelfde tijdsperiode.
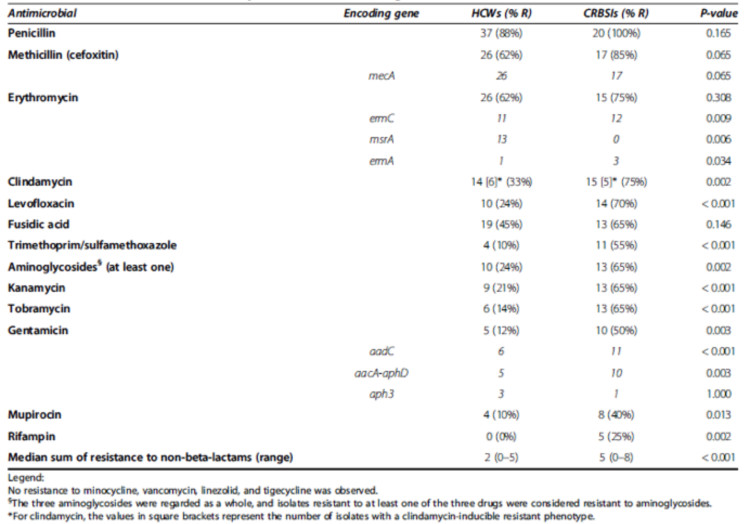
We hebben vastgesteld dat de S. epidermidis die verantwoordelijk zijn voor CLABSI resistenter zijn tegen de 12 geteste antibiotica dan de monsters die afkomstig zijn van de handen van de zorgverstrekkers, behalve voor meticilline, penicilline, erythromycine en fusidinezuur. De mec chromosoomcassette van de stafylokok type IV (44%) wordt het meest frequent aangetroffen (zie Tabel 1).
Het ica-operon is significant vaker aanwezig bij invasieve stammen dan bij stammen die de zorgverstrekkers koloniseren. Stammen die in vitro een biofilm hebben gevormd met een aanzienlijke biomassa, zijn hoofdzakelijk ica positief. Omgekeerd produceren ica negatieve stammen in meer dan 90% van de gevallen geen in vitro biofilm.
Een derde van alle S. epidermidis is genetisch identiek (via PFGE) bij die afkomstig van de zorgverstrekkers en die verantwoordelijk voor CLABSI. Dit toont aan dat de zorgverstrekkers kunnen fungeren als reservoir voor stammen en/of verspreider van bepalende factoren voor de antibioticaresistentie, zoals de meticillineresistentie.
Epidemiologisch gesproken vertegenwoordigen de epidemische pulsotypes van S. epidermidis, die gemeenschappelijk zijn voor de 3 subpopulaties (gezonde vrijwilligers – CLABSI – zorgverstrekkers) 1/5de van de stammen, maken deel uit van 4 MLST (ST153, ST130, ST89 en ST59), zijn zeer weinig antibioticaresistent en weinig virulent.
De multiresistente, mecA positieve en icaA positieve ST2-stammen daarentegen, die enkel worden aangetroffen bij de patiënten met CLABSI en frequent worden geassocieerd met ernstige klinische ziektebeelden, worden noch bij de gezonde vrijwilligers, noch bij de zorgverstrekkers aangetroffen. Deze klonen lijken bijzonder goed aangepast aan de ziekenhuisomgeving.
Table 1. Antimicrobial resistance profiles and resistance (R)-encoding genes of S. epidermidis isolates collected from healthcare workers (HCWs; n =42) vs. S. epidermidis isolates causing catheter-related bloodstream infections (CRBSIs; n = 20)
Discussie
We hebben aangetoond dat de bestudeerde S. epidermidis-ziekenhuisstammen, die afkomstig zijn van de handen van zorgverstrekkers en die verantwoordelijk zijn voor CLABSI, resistent zijn tegen meer antibiotica dan de commensale stammen die in de gemeenschap circuleren, en dat de S. epidermidis die de gezonde vrijwilligers koloniseren, multigevoelig en bijna altijd meticilline–gevoelig zijn. Bovendien zijn de S. epidermidis van zorgverstrekkers statistisch tegen minder antibiotica resistent dan die die verantwoordelijk zijn voor CLABSI, met uitzondering van meticilline. Deze resultaten sluiten aan bij andere studies die zijn uitgevoerd bij gezonde personen en vormen een sterke aanwijzing van een verband tussen de antibioticaresistentie die wordt vastgesteld bij ziekenhuisstammen en de druk van antibioticaselectie, die op haar beurt te maken heeft met het veelvuldige gebruik van deze moleculen in de ziekenhuisomgeving (Li et al., 2009; Rolo et al., 2012).
We hebben een grote variëteit vastgesteld binnen de mec chromosoomcassettes van de stafylokok bij meticilline-resistente S. epidermidis (MRSE), verantwoordelijk voor CLABSI bij gehospitaliseerde patiënten en bij zorgverstrekkers. De mec chromosoomcassette van de stafylokok type IV is de meest frequent geïdentificeerde, gevolgd door de mec chromosoomcassette van de stafylokok type III, zoals beschreven in andere studies (Otto, 2009; Du et al., 2013). De S. epidermidis-stammen zouden dienen als reservoirs van de mec chromosoomcassette van de stafylokok voor de S. aureus.
Het ACME (arginine catabolic mobile element) eilandje is een mobiel genoomelement dat aanvankelijk was beschouwd als een belangrijke virulentiefactor door zijn aanwezigheid in de pathogene stam S. aureus USA300. We hebben het ACME aangetroffen in 2/3 van de geanalyseerde S. epidermidis-stammen, zoals ook in andere publicaties wordt gemeld (Miragaia et al., 2009; Barbier et al., 2011) en dit ongeacht de oorsprong van die stammen, gezonde vrijwilligers of CLABSI. Hoewel aanwezig in de stam MRSA USA300 (Diep et al., 2008) zou het ACME geen virulentiefactor op zicht zijn, maar zou het de kolonisatie en de overleving van de S. epidermidis op de huid en in een zure omgeving bevorderen.
Zoals bekend is de productie van PIA, een polysacharide die essentieel is voor de maturatie van de biofilm, afhankelijk van de expressie van het ica (intercellular adhesin) operon. In onze studie wordt het icaA-operon significant meer aangetroffen in de stammen verantwoordelijk voor CLABSI dan bij stammen die zijn geïsoleerd bij gezonde vrijwilligers en op de handen van zorgverstrekkers. Bovendien wordt de aanwezigheid van ica geassocieerd met een ernstiger klinisch beeld van CLABSI. De meeste S. epidermidis-stammen die een belangrijke in vitro biofilm produceren zijn dragers van het ica-operon, terwijl de meeste S. epidermidis-stammen die er geen produceren ica negatief zijn, wat een klassieke waarneming is (Mertens and Ghebremedhin, 2013). De stammen die biofilm produceren worden, ongeacht de intensiteit van de geobserveerde biomassa, aangetroffen in de drie subpopulaties en niet bepaald meer in de subgroep van stammen verantwoordelijk voor CLABSI.
We hebben vastgesteld dat de detectie van het ica-operon niet altijd wordt geassocieerd met de vorming van een in vitro biofilm. Verrassender is dat de meeste van die “ica positieve/biofilm negatieve” stammen behoren tot de subgroep van S. epidermidis verantwoordelijk voor CLABSI. In de literatuur is de productie van in vitro biofilm significant hoger bij de stammen die verantwoordelijk zijn voor infecties dan bij destammen verantwoordelijk voor dragerschap (Arciola et al., 2001; Kozitskaya et al., 2004; Du et al., 2013; Mertens and Ghebremedhin, 2013). Dit verschil met onze waarnemingen kan te wijten zijn aan de manier waarop monsters worden genomen bij de gezonde vrijwilligers (meestal uitstrijkje van de neus en niet van de huid) en aan de verscheidenheid aan geselecteerde infectieplaatsen (urineweginfecties, septicemieën, katheters). De omstandigheden waarin wij de experimenten hebben gevoerd, hadden het inactiveren van de ica-genen misschien kunnen bevorderen. Hoe het ook zij, de vorming van biofilm is van heel wat factoren afhankelijk en de regulatie ervan is complex. Extrapolatie van de vorming van in vivo biofilm op basis van in vitro waarnemingen is moeilijk. De in vivo randvoorwaarden op vlak van stress, oxygenatie, pH en aanwezigheid van antibiotica zijn variabel, hebben een invloed op de vorming van de biofilm en zijn niet gereproduceerd tijdens in vitro waarnemingen (Fitzpatrick et al., 2002). De S. epidermidis afkomstig van de drie bestudeerde subpopulaties zijn genetisch zeer gevarieerd (via PFGE) met slechts 1/5 gemeenschappelijke pulsotypes voor de drie populaties, zijn zeer weinig antibioticaresistent en weinig virulent. Ook andere studies maken gewag van deze grote diversiteit, zowel in de ziekenhuisomgeving als in de gemeenschap (Bogado et al., 2002; Nunes et al., 2005; Rolo et al., 2012). Dit onderstreept de mate waarin S. epidermidis-isolaten zich kunnen aanpassen aan heel verschillende omgevingen (Miragaia et al., 2007). Deze afzonderlijke populaties zijn daarentegen gedeeltelijk verbonden op fylogenetisch vlak omdat de meeste epidemische klonen, die afkomstig zijn uit zowel de gemeenschap als de ziekenhuisomgeving, tot eenzelfde klonaal complex (CC) behoren, met name CC2 dat voordien reeds is beschreven (Rolo et al., 2012). Twee specifieke klonen (ST2 en SLV (single locus variant) ST54) worden enkel aangetroffen in de groep S. epidermidis verantwoordelijk voor CLABSI. De type ST2-isolaten zijn goed voor zo’n 20% van alle S. epidermidis afkomstig van CLABSI, wat iets minder is dan in de literatuur is beschreven, waar ze de grootste groep zijn die verantwoordelijk is voor ziekenhuisinfecties (van alle oorsprong: urinair, geïnfecteerd materiaal …). Deze hoofdzakelijk ziekenhuiskloon wordt overal ter wereld aangetroffen, dus zowel in de Verenigde Staten, Australië, China als in Noord-Europa (Widerstrom et al., 2009; Gordon et al., 2012; Widerstrom et al., 2012; Du et al., 2013). Blijkbaar heeft het intussen een epidemisch en virulentiepotentieel opgebouwd waardoor het zich in de ziekenhuisomgeving kan verspreiden.
Het klinisch beeld van de S. epidermidis verantwoordelijk voor CLABSI, die behoren tot de (zogenaamde “ziekenhuis-“) ST2 en SLV ST54, is ernstiger dan dat van de andere S. epidermidis. De S. epidermidis verantwoordelijk voor CLABSI daarentegen met een minder ernstig klinisch beeld en die behoren tot pulsotypes die worden waargenomen bij de gezonde vrijwilligers, zijn ica negatief. Dit wijst erop dat deze minder virulente stammen vermoedelijk hun oorsprong vonden in de gemeenschap. Bovenop de factoren die met de gastheer te maken hebben, bestaat er mogelijks een verband tussen het genetische type S. epidermidis en de ernst van de infectie.
In onze studie deelt 1/3 van alle S. epidermidis-stammen, die zijn geïsoleerd bij de zorgverstrekkers en bij diegenen die verantwoordelijk zijnvoor CLABSI, dezelfde pulsotypes. Deze gemeenschappelijke klonen behoren, via MLST, tot ST22 en ST5. Op basis van deze waarneming kunnen we stellen dat de zorgverstrekkers minstens gedeeltelijk kunnen fungeren als vector van S. epidermidis verantwoordelijk voor CLABSI. De klonen ST2 en ST54 daarentegen, die uitsluitend worden aangetroffen bij de S. epidermidis verantwoordelijk voor CLABSI en die worden geassocieerd met de meest ernstige klinische beelden, worden niet aangetroffen op de handen van de zorgverstrekkers. Buiten een epidemische context blijft CLABSI evenwel een zeldzame gebeurtenis. De willekeurige bemonstering kan een verklaring zijn voor onze resultaten: ofwel zijn de zorgverstrekkers slechts tijdelijke dragers van “ziekenhuis-” S. epidermidis, zoals in het model van de overdracht van MRSA in ziekenhuizen via de handen, ofwel zijn het chronische dragers die deze bijzondere flora kunnen verliezen na een periode buiten het ziekenhuis, zoals is aangetoond in andere studies (Hira et al., 2010).
Het S. epidermidis-reservoir dat aan de basis ligt van kathetersepticemieën beperkt zich niet tot de handen van zorgverstrekkers. In de literatuur wordt melding gemaakt van CNS-infecties overgedragen door zorgverstrekkers, maar ook tussen patiënten onderling (Milisavljevic et al., 2005; Liakopoulos et al., 2008). De ziekenhuisomgeving, zoals de oppervlakken, kunnen fungeren als reservoir van pathogene S. epidermidis (Kelly et al., 2008). Ook de lucht kan een rol spelen als reservoir of bij de overdracht van S. epidermidis. Zo werden via pulsotypering identieke CNS aangetroffen in luchtmonsters in het ziekenhuis en op patiënten (Botelho et al., 2012), en zelf in de lucht van woningen van personen die regelmatig in het ziekenhuis komen (Lis et al., 2009). In deze studie zijn deze hypotheses niet verder onderzocht. Daarvoor waren monsters van de oppervlakken en de lucht nodig, niet enkel om de aanwezigheid van S. epidermidis te kunnen aantonen, maar vooral om de rol van de overdracht via de lucht bij de verspreiding ervan te onderzoeken.
De twee belangrijkste manieren om een kathetersepsis te verwerven zijn via de extraluminale weg – in episodes die zich vooral voordoen tijdens de eerste week van de plaatsing van de katheter – en via de endoluminale weg. De eerste weg ontwikkelt zich vermoedelijk via de S. epidermidis die behoort tot de commensale flora van de huid van de patiënt en bij de tweede weg zouden dan eerder S. epidermidis uit de “ziekenhuisomgeving” betrokken zijn. In onze studies is de hospitalisatieduur van patiënten met CLABSI als gevolg van S. epidermidis, die behoren tot ziekenhuisgenotypes, significant langer (26 dagen tegenover 13 dagen) dan diegene die behoren tot de genotypes uit de gemeenschap. Het gaat dan vooral om patiënten die de maand tevoren zijn blootgesteld aan antibiotica en die al geruime tijd een katheter ter plaatse hebben. CLABSIs die in een later tijdstip van de hospitalisatie worden vastgesteld en/of van de levensduur van de katheter, zijn meestal te wijten aan ica positieve S. epidermidis-stammen, vaak mecA postief, multiresistent, ST2 en met een ernstig klinisch beeld, wat meteen ook bevestigt dat ze veeleer uit het ziekenhuis afkomstig zijn. Deze S. epidermidis zijn naar verluidt hardnekkig in de ziekenhuisomgeving, zoals reeds beschreven in de literatuur voor de CNS (Neely and Maley, 2000; Widerstrom et al., 2006), en worden mogelijks overgedragen via manipulatie aan de katheter door contact met de handen van zorgverstrekkers. Die ziekenhuis-S. epidermidis zouden vervolgens de patiënt koloniseren door vorming van een nieuwe huidflora, die op haar beurt mogelijks verantwoordelijk is voor een extraluminale besmetting bij de plaatsing van een katheter in de loop van de hospitalisatie of bij het vervangen van een verband.
Ter ondersteuning van deze hypothese zou het interessant zijn huiduitstrijkjes van patiënten te nemen tijdens hun hospitalisatie, om niet alleen een wijziging van hun flora, de snelheid waarmee die zich voordoet, het eventuele verwerven van een S. epidermidis-flora die ica positief en multiresistent is tegen antibiotica, op te sporen maar ook de invloed van het nemen van antibiotica op deze dynamiek, zoals aangetoond op een goed gedocumenteerd klinisch geval. Bij deze gehospitaliseerde patiënt is de samenstelling van de huidflora geleidelijk aan gewijzigd van S. epidermidis-stammen met genotypische profielen die gevarieerd en multigevoelig aan antibiotica zijn, naar één enkele specifieke stam van multiresistente en virulente S. epidermidis. Deze patiënt heeft daarna verschillende opeenvolgende episodes van CLABSI vertoond als gevolg van die gewijzigde S. epidermidis (Blum-Menezes et al., 2009).
Een andere mogelijke hypothese is dat de meer virulente S. epidermidis-stammen minder aanwezig zijn op de huid omdat het voor bacteriën – rekening houdend met de mate waarin ze zich kunnen voortplanten – minder voordelig zou zijn om biofilm te produceren (notie van fitness cost). Ze zouden dus in mindere mate aanwezig zijn op de huid en op die manier dus zijn ontsnapt aan onze monstername via uitstrijkjes van de hals of vingerafdrukken, terwijl ze daarentegen bij voorkeur materiaal zouden koloniseren. Er zou dus een selectiebias zijn bij de vergeleken S. epidermidis, met dien verstande dat bij de in onze studie gebruikte techniek, er slechts één stam per monstername is geanalyseerd.
Conclusie
We hebben aangetoond dat de S. epidermidis een grote genetische diversiteit vertoont en een zeer verschillende antibioticaresistentie, al naargelang ze de huid van gezonde vrijwilligers of de handen van zorgverstrekkers koloniseren, dan wel of ze een sepsis veroorzaken. Bij de geïdentificeerde mec chromosoomcassettes van de stafylokok hebben we een grote diversiteit vastgesteld, wat wijst op een grote flexibiliteit van hun genoom. We hebben ook vastgesteld dat de aanwezigheid van het icaA-gen significant frequenter is bij de S. epidermidis verantwoordelijk voor CLABSI dan bij de commensale stammen. Het ACME-eilandje daarentegen, dat evenveel aanwezig is in 2/3 van onze stammen, zou geen rol spelen in de pathogeniciteit van S. epidermidis. We hebben vastgesteld dat een derde van de S. epidermidis-stammen die zijn geïsoleerd op de handen van zorgverstrekkers genetisch identiek is aan bepaalde stammen die verantwoordelijk zijn voor CLABSI en dat zorgverstrekkers dus kunnen fungeren als reservoir van stammen van pathogene en resistente S. epidermidis. Bovendien hebben we vastgesteld dat de meest ernstige klinische beelden van CLABSI worden geassocieerd met S. epidermidis die tot een specifieke genetische lijn behoren (ST2 en SLV ST54), alle icaA positief, mecA positief en multiresistent aan antibiotica, en die we niet hebben aangetroffen bij de gezonde vrijwilligers, noch op de handen van zorgverstrekkers. De S. epidermidis die veel biofilm aanmaken zijn ica positief en de meeste ica negatieve stammen produceren geen biofilm. Maar de aanwezigheid van het icaA-operon wordt niet altijd geassocieerd met de vorming van in vitro biofilm, vooral bij de stammen die verantwoordelijk zijn voor CLABSI. De twee belangrijkste wegen, de endoluminale en extraluminale, die betrokken zijn bij de pathogenese van CLABSI met S. epidermidis, moeten gelijktijdig worden bekeken in een praktische benadering om katheterinfecties te vermijden.
Referenties (in volgorde van verschijning in de tekst)
1. Tacconelli, E., Smith, G., Hieke, K., Lafuma, A., Bastide, P., 2009. Epidemiology, medical outcomes and costs of catheter-related bloodstream infections in intensive care units of four European countries: literature- and registry-based estimates. J. Hosp. Infect. 72, 97-103.
2. Cherifi, S., Jacobs, F., Strale, H., Struelens, M., Byl, B., 2007. Outcome of totally implantable venous access device-related bacteraemia without device removal. Clin. Microbiol. Infect. 13, 592-598.
3. Cherifi, S., Byl, B., Deplano, A., Nagant, C., Nonhoff, C., Denis, O., Hallin, M., 2014. Genetic characteristics and antimicrobial resistance of Staphylococcus epidermidis isolates from patients with catheter-related bloodstream infections and from colonized healthcare workers in a Belgian hospital. Ann. Clin. Microbiol. Antimicrob. 13, 20.
4. Cherifi, S., Byl, B., Deplano, A., Nonhoff, C., Denis, O., Hallin, M., 2013a. Comparative epidemiology of Staphylococcus epidermidis isolates from patients with catheter-related bacteremia and from healthy volunteers. J. Clin. Microbiol. 51, 1541-1547.
5. Deplano, A., Vaneechoutte, M., Verschraegen, G., Struelens, M.J., 1997. Typing of Staphylococcus aureus and Staphylococcus epidermidis strains by PCR analysis of inter-IS256 spacer length polymorphisms. J. Clin. Microbiol. 35, 2580-2587.
6. Piessens, V., Van, C.E., Verbist, B., Supre, K., Braem, G., Van, N.A., De, V.L., Heyndrickx, M., De, V.S., 2011. Distribution of coagulase-negative Staphylococcus species from milk and environment of dairy cows differs between herds. J. Dairy Sci. 94, 2933-2944.
7. Vanderhaeghen, W., Vandendriessche, S., Crombe, F., Dispas, M., Denis, O., Hermans, K., Haesebrouck, F., Butaye, P., 2012. Species and staphylococcal cassette chromosome mec (SCCmec) diversity among methicillin-resistant non-Staphylococcus aureus staphylococci isolated from pigs. Vet. Microbiol. 158, 123-128.
8. Li, M., Wang, X., Gao, Q., Lu, Y., 2009. Molecular characterization of Staphylococcus epidermidis strains isolated from a teaching hospital in Shanghai, China. J. Med. Microbiol. 58, 456-461.
9. Rolo, J., de, L.H., Miragaia, M., 2012. Strategies of adaptation of Staphylococcus epidermidis to hospital and community: amplification and diversification of SCCmec. J. Antimicrob. Chemother. 67, 1333-1341.
10. Otto, M., 2009. Staphylococcus epidermidis–the ‘accidental’ pathogen. Nat. Rev. Microbiol. 7, 555-567.
11. Du, X., Zhu, Y., Song, Y., Li, T., Luo, T., Sun, G., Yang, C., Cao, C., Lu, Y., Li, M., 2013. Molecular analysis of Staphylococcus epidermidis strains isolated from community and hospital environments in China. PLoS. One. 8, e62742.
12. Miragaa, M., de, L.H., Perdreau-Remington, F., Chambers, H.F., Higashi, J., Sullam, P.M., Lin, J., Wong, K.I., King, K.A., Otto, M., Sensabaugh, G.F., Diep, B.A., 2009. Genetic diversity of arginine catabolic mobile element in Staphylococcus epidermidis. PLoS. One. 4, e7722.
13. Barbier, F., Lebeaux, D., Hernandez, D., Delannoy, A.S., Caro, V., Francois, P., Schrenzel, J., Ruppe, E., Gaillard, K., Wolff, M., Brisse, S., Andremont, A., Ruimy, R., 2011. High prevalence of the arginine catabolic mobile element in carriage isolates of methicillin-resistant Staphylococcus epidermidis. J. Antimicrob. Chemother. 66, 29-36.
14. Diep, B.A., Otto, M., 2008. The role of virulence determinants in community-associated MRSA pathogenesis. Trends Microbiol. 16, 361-369.
15. Mertens, A., Ghebremedhin, B., 2013. Genetic determinants and biofilm formation of clinical Staphylococcus epidermidis isolates from blood cultures and indwelling devises. Eur. J. Microbiol. Immunol. (Bp) 3, 111-119.
16. Arciola, C.R., Baldassarri, L., Montanaro, L., 2001. Presence of icaA and icaD genes and slime production in a collection of staphylococcal strains from catheter-associated infections. J. Clin. Microbiol. 39, 2151-2156.
17. Kozitskaya, S., Cho, S.H., Dietrich, K., Marre, R., Naber, K., Ziebuhr, W., 2004. The bacterial insertion sequence element IS256 occurs preferentially in nosocomial Staphylococcus epidermidis isolates: association with biofilm formation and resistance to aminoglycosides. Infect. Immun. 72, 1210-1215.
18. Fitzpatrick, F., Humphreys, H., Smyth, E., Kennedy, C.A., O’Gara, J.P., 2002. Environmental regulation of biofilm formation in intensive care unit isolates of Staphylococcus epidermidis. J. Hosp. Infect. 52, 212-218.
19. Bogado, I., Limansky, A., Sutich, E., Marchiaro, P., Marzi, M., Putero, J., Viale, A., 2002. Molecular characterization of methicillin-resistant coagulase-negative staphylococci from a neonatal intensive care unit. Infect. Control Hosp. Epidemiol. 23, 447-451.
20. Nunes, A.P., Teixeira, L.M., Bastos, C.C., Silva, M.G., Ferreira, R.B., Fonseca, L.S., Santos, K.R., 2005. Genomic characterization of oxacillin-resistant Staphylococcus epidermidis and Staphylococcus haemolyticus isolated from Brazilian medical centres. J. Hosp. Infect. 59, 19-26.
21. Miragaia, M., Thomas, J.C., Couto, I., Enright, M.C., de, L.H., 2007. Inferring a population structure for Staphylococcus epidermidis from multilocus sequence typing data. J. Bacteriol. 189, 2540-2552.
22. Widerstrom, M., Monsen, T., Karlsson, C., Edebro, H., Johansson, A., Wistrom, J., 2009. Clonality among multidrug-resistant hospital-associated Staphylococcus epidermidis in northern Europe. Scand. J. Infect. Dis. 41, 642-649.
23. Widerstrom, M., McCullough, C.A., Coombs, G.W., Monsen, T., Christiansen, K.J., 2012. A multidrug-resistant Staphylococcus epidermidis clone (ST2) is an ongoing cause of hospital-acquired infection in a Western Australian hospital. J. Clin. Microbiol. 50, 2147-2151.
24. Gordon, R.J., Miragaia, M., Weinberg, A.D., Lee, C.J., Rolo, J., Giacalone, J.C., Slaughter, M.S., Pappas, P., Naka, Y., Tector, A.J., de, L.H., Lowy, F.D., 2012. Staphylococcus epidermidis colonization is highly clonal across US cardiac centers. J. Infect. Dis. 205, 1391-1398.
25. Hira, V., Sluijter, M., Goessens, W.H., Ott, A., de, G.R., Hermans, P.W., Kornelisse, R.F., 2010. Coagulase-negative staphylococcal skin carriage among neonatal intensive care unit personnel: from population to infection. J. Clin. Microbiol. 48, 3876-3881.
26. Liakopoulos, V., Petinaki, E., Efthimiadi, G., Klapsa, D., Giannopoulou, M., Dovas, S., Eleftheriadis, T., Mertens, P.R., Stefanidis, I., 2008. Clonal relatedness of methicillin-resistant coagulase-negative staphylococci in the haemodialysis unit of a single university centre in Greece. Nephrol. Dial. Transplant. 23, 2599-2603.
27. Milisavljevic, V., Wu, F., Cimmotti, J., Haas, J., Della-Latta, P., Larson, E., Saiman, L., 2005. Genetic relatedness of Staphylococcus epidermidis from infected infants and staff in the neonatal intensive care unit. Am. J. Infect. Control 33, 341-347.
28. Kelly, S., Collins, J., Maguire, M., Gowing, C., Flanagan, M., Donnelly, M., Murphy, P.G., 2008. An outbreak of colonization with linezolid-resistant Staphylococcus epidermidis in an intensive therapy unit. J. Antimicrob. Chemother. 61, 901-907.
29. Botelho, A.M., Nunes, Z., Asensi, M.D., Gomes, M.Z., Fracalanzza, S.E., Figueiredo, A.M., 2012. Characterization of coagulase-negative staphylococci isolated from hospital indoor air and a comparative analysis between airborne and inpatient isolates of Staphylococcus epidermidis. J. Med. Microbiol. 61, 1136-1145.
30. Neely, A.N., Maley, M.P., 2000. Survival of enterococci and staphylococci on hospital fabrics and plastic. J. Clin. Microbiol. 38, 724-726.
31. Widerstrom, M., Monsen, T., Karlsson, C., Wistrom, J., 2006. Molecular epidemiology of meticillin-resistant coagulase-negative staphylococci in a Swedish county hospital: evidence of intra- and interhospital clonal spread. J. Hosp. Infect. 64, 177-183.
32. Blum-Menezes, D., Bratfich, O.J., Padoveze, M.C., Moretti, M.L., 2009. Hospital strain colonization by Staphylococcus epidermidis. Braz. J. Med. Biol. Res. 42, 294-298.
Nieuwigheden
Wetenschappelijke agenda
- oktober 2024
-
van 16/10 tot 20/10 || in Los Angeles
SHEA ID week. A joint meeting of IDSA, SHEA, HIVMA, PIDS and SIDP
- november 2024
-
van 20/11 tot 22/11 || in Liverpool
Healthcare infection society
- april 2025
-
van 11/04 tot 15/04 || in Wenen
Congrès de l’ European Society of Clinical Microbiology and Infectious Diseases (ESCMID)
- juni 2025
-
van 4/06 tot 6/06 || in Marseille
35ème Congrès National de la Société Française d’Hygiène Hospitalière (SF2H)
-
van 17/06 tot 18/06 || in Londen
HIS congres (Healthcare Infection Society)