Risico’s op overdracht van het cytomegalovirus via de moedermelk bij prematuren

Inleiding
Het cytomegalovirus (CMV), dat tot de groep van de Herpesvirussen behoort, komt overal ter wereld voor. Het virus is verantwoordelijk voor latente infecties en kan die ook reactiveren. De overdracht gebeurt via lichaamsvochten zoals speeksel, urine en genitale secreties. (1) Het wordt ook aangetroffen in bloed, moedermelk (MM) en alle weefsels, maar vooral in het epitheel- en klierweefsel.(2) De seroprevalentie schommelt tussen de 45 à 100%. (3) CMV wordt beschouwd als de hoofdoorzaak van congenitale infectie in de ontwikkelde landen (4, 5) en is de belangrijkste verwekker van mentale achterstand en niet erfelijk neurosensorieel gehoorverlies.(2)
Bij baby’s kan het postnatale infecties veroorzaken die vooral via de moedermelk (MM) van seropositieve moeders worden doorgegeven. Van de geïmmuniseerde moeders scheidt 66 à 96% in de drie eerste maanden na de bevalling CMV uit in de moedermelk.(6)
Bij een voldragen pasgeborene, die beschermd is door de antilichamen van de moeder, verloopt de postnatale infectie over het algemeen zonder symptomen en is er geen impact op de cognitieve ontwikkeling van het kind. Door de onvolledige ontwikkeling van hun immuunsysteem en de onvolledige transplacentaire overdracht van IgG-antistoffen van de moeder is het risico op overdracht en symptomatische infecties met mogelijke gevolgen op langere termijn groter bij prematuren jonger van 32 weken zwangerschapsleeftijd (WZL) of bij prematuren die bij de geboorte minder dan 1500g wegen.(7-9) Het overdrachtscijfer dat bij prematuren wordt vastgesteld, schommelt tussen de 5,6 en 58,6%, al naargelang de manier waarop de melk wordt verwerkt en de onderzoeksmethode.(6) Het risico op een symptomatische infectie kan 34,5% bedragen en dat op ernstige klinische verschijnselen 14%.(6)
Over het risico op langetermijngevolgen is niet zo veel bekend. Op basis van het geringe aantal studies over dat onderwerp is men het nog niet eens over de mate waarin preventiemaatregelen nodig zijn.
De samenstelling van de moedermelk is aangepast aan het te vroeg geboren kind en beschikt over unieke voedings- en anti-infectieuze eigenschappen. Bovendien bevat de melk lipiden met antivirale eigenschappen en beschermende IgA-antistoffen. In vitro is gebleken dat vitamine A, monolaurine en lactorferrine de groei van CMV in de MM kunnen afremmen.(10) Momenteel zijn de technieken van virale inactivatie in de melk bij geïmmuniseerde moeders ontoereikend, omdat ze het verlies van bioactieve stoffen in de hand werken. De voordelen van het toedienen van rauwe melk moet worden afgewogen tegen het risico op CMV-infectie bij prematuren.
Kinetiek van de uitscheiding van CMV in de MM
CMV kan in de MM worden gedetecteerd via celkweek (viro-lactatie) en via een kwalitatieve of kwantitatieve PCR-test (DNA-lactatie). In een centrifuge wordt eerst de melkwei in het staal geïsoleerd om problemen te vermijden met de intrinsieke toxiciteit van de niet-gefractioneerde melk, waardoor de vrije virussen kunnen worden opgespoord.(11) Bij geïmmuniseerde moeders die borstvoeding geven wordt in 67 à 97% van de gevallen een DNA-lactatie vastgesteld en in 63 à 85% van de gevallen een viro-lactatie.(12) De uitscheiding van CMV in de MM is een proces met een zelf limiterend karakter . Het begint in de eerste weken na de bevalling: de virale belasting is maximaal tussen 4-8 weken na de geboorte en daalt drastisch rond 12 weken.(11) Het virus wordt dus vaker aangetroffen in rijpe MM dan in het colostrum. Toch werd ook melding gemaakt van positieve viruskweken van de eerste dagen tot 9 maanden na de bevalling.(13)
DNA-lactatie en viro-lactatie zijn risicofactoren voor de overdracht van CMV. DNA-lactatie in de melkwei is in tegenstelling tot viro-lactatie, een noodzakelijke voorwaarde voor de overdracht.(14, 15)
Uit die technieken zijn weinig verschillen gebleken tussen de uitscheidingsdynamiek van moeders die het virus doorgeven en zij die het niet doorgeven. Het ogenblik van de overdracht valt samen met de viro-lactatie en de maximale DNA-lactatie, zonder dat er een drempel wordt vastgesteld.(11) Toch zijn het serologisch statuut (IgM) en de PCR in het bloed over het algemeen negatief bij moeders die het virus doorgeven. De reactivatie tijdens de borstvoeding zou dus een fenomeen zijn dat beperkt blijft tot de melkklier, maar het exacte mechanisme erachter blijft onbekend.(11, 16, 17)
Klinische gevolgen op korte termijn
Bij een voldragen pasgeborene ontwikkelt een CMV-infectie zich over het algemeen zonder symptomen, ook al wordt erkend dat het virus bij zuigelingen een longontsteking kan veroorzaken.(9, 18)
Door de onvolledige ontwikkeling van hun immuunsysteem en de onvolledige transplacentaire overdracht van IgG-antistoffen van de moeder, lopen prematuren een hoger risico op ernstige infecties, vooral zij die geboren zijn voor 30 WZL of die bij de geboorte geen 1000g wegen.(19, 20) Kenmerken van de symptomatische CMV-infectie zijn vooral biologische anomalieën zoals thrombopenie, neutropenie, veranderde leverfunctietesten en/of verhoging van het ‘C-reactive proteine’ maar ook cholestase, een klinische verslechtering, tekenen van “sepsis like syndrome”, een longontsteking of necrotiserende enterocolitis zijn mogelijk.(6, 12, 15, 21) In een aantal zeldzame gevallen is melding gemaakt van gevallen van het macrofaagactivatiesyndroom, perineale zweren of digestieve perforatie.(22-24) Toch lijken de symptomen van CMV bij een prematuur in goede gezondheid mee te vallen. Het zou eerder een factor zijn die mee de klinische situatie verslechtert, in geval van een reeds aanwezige long-, hepatitische of hematologische aandoening.(25, 26) In een retrospectieve studie met 40 besmette prematuren konden de auteurs tijdens de hospitalisatie geen bijkomende morbiditeit vaststellen. Uit de studie blijkt er immers geen verband met het optreden van intraventriculaire bloedingen, periventriculaire leucomalacie, bronchodysplasie of retinopathie van de prematuur hoger dan stadium 2 of van necrotiserende enterocolitis. Bovendien was er wat de duur van de hospitalisatie, intubatie of zuurstoftherapie, en de antropometrische gegevens betreft geen significant verschil tussen de gevallen en de controlegroep.(25) CMV wordt als oorzaak van die infecties beschouwd, wanneer het wordt opgespoord samen met klinische symptomen die ermee in verband kunnen worden gebracht. In ernstige gevallen kan worden gedacht aan een ganciclovirbehandeling van 2 à 6 weken, maar meestal verdwijnt de infectie spontaan.(6, 9) Risicofactoren van een symptomatische infectie zijn vroegtijdige reactivering bij de moeder (< 1 week), vroegtijdige postnatale infectie (< 2 maand), immaturiteit (< 32 WZL, < 1500g) (9, 15), en bijkomende morbiditeit (25, 26). En bovendien, hoe groter de prematuriteit en hoe vroeger de infectie zich voordoet, des te groter is het risico op symptomatische infectie (27).
Klinische gevolgen op lange termijn
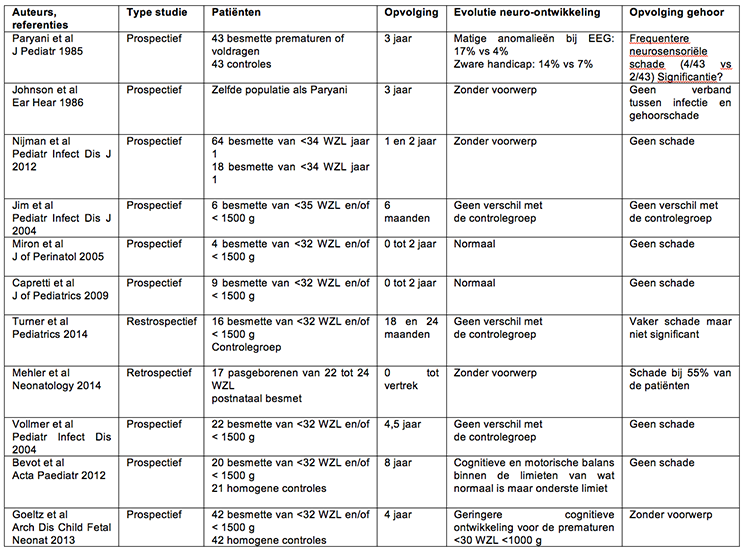
Naar de gevolgen op lange termijn van vroegtijdige postnatale CMV-infecties bij prematuren is nog weinig onderzoek verricht. Het gaat dan vooral om neurologische, cognitieve en/of auditieve stoornissen. De resultaten van die studies staan vermeld in Tabel I. Paryani et al. (28) hebben de gevolgen op 3 jaar geëvalueerd bij besmette pasgeborenen, ongeacht hun zwangerschapsleeftijd. De incidentie van de neurologische gevolgen lag niet hoger bij kinderen die bij de geboorte meer dan 2000g wogen. Zij die bij de geboorte geen 2000g wogen, hadden wel een verhoogd risico op gevolgen of handicap in geval van infectie voordat ze 2 maanden oud waren. Neurosensoriële gehoorschade was twee maal frequenter in de besmette groep maar statistisch niet significant.(28, 29) In het cohort van prematuren van minder dan 34 WZL van Nijman et al. werd geen enkele gehoorschade vastgesteld op 2 jaar, maar tijdens het tweede jaar werden slechts 8 prematuren van <27 WZL en 2 symptomatische prematuren getest.(30) In de studie van Jim et al., was de neuro-ontwikkelings- en auditieve opvolging op 6 maanden vergelijkbaar tussen 6 besmette prematuren en de controlegroep(31), de opvolging van 4 besmette pasgeborenen in de studie van Miron et al. was normaal op 24 maanden(32) en ook de waarnemingen van Capretti et al. zijn geruststellend: bij 9 door de MM besmette prematuren was de neuro-ontwikkelings-, visuele en auditieve opvolging normaal op 2 jaar. Opvallend was wel dat slechts 3 van de kinderen een symptomatische infectie hadden vertoond.(26) Turner et al. daarentegen wijzen op frequentere gehoorschade bij besmette kinderen. Hun resultaten zijn evenwel niet significant (33). In het cohort van extreme prematuren tenslotte van Mehler et al., was bij 55% van de besmette patiënten de auditieve test abnormaal bij het verlaten van de dienst. Bij 65% van de patiënten was er een symptomatische infectie aanwezig en bij 55% onder hen, een “sepsis like”.(34) In het centrum van Tübingen hebben Vollmer et al. de evolutie op 2 en 4,5 jaar van 22 besmette prematuren vergeleken met een homogene controlegroep. De antropometrische gegevens en de psychomotorische ontwikkeling tussen de groepen waren vergelijkbaar. Gehoorschade werd niet vastgesteld.(35) Op 8 jaar lagen diezelfde parameters binnen de normen, maar de motorische en cognitieve functies waren iets minder goed bij de kinderen met een vroege besmetting tijdens de postnatale periode.(36) Goeltz et al. hebben hetzelfde cohort gebruikt en er patiënten in opgenomen die tijdens 2 bijkomende jaren waren gerekruteerd. Hun doelstelling was om de cognitieve capaciteiten te kwantificeren van de individuen na 4 jaar opvolging, dankzij een test dat de Kaufman Assessment Battery for Children (K-ABC) wordt genoemd. De scores van de 42 besmette kinderen leken lager dan die van de controlegroep, en dan vooral bij de subgroep kinderen die geboren werden vóór 30 WZL of met een geboortegewicht <1000g (37). Studies hebben ook aandacht besteed aan beeldvormende diagnoses bij die patiënten op korte en lange termijn. In een studie heeft een derde van de pasgeborenen die postnataal een CMV-besmetting heeft opgelopen, een lenticulostriaire vaatonsteking ontwikkeld. Dit echografische beeld was 4x frequenter bij besmettedan bij niet-besmette prematuren, en dit zonder dat er symptomen waren. De gevolgen op de neurologische ontwikkeling zijn onbekend en opvolging op lange termijn wordt aangeraden. Geen van de besmette patiënten uit deze studie vertoonde symptomen.(38) Onlangs heeft een andere studie de MRI-scans analyseerde van 34 voormalige prematuren (15 met en 19 zonder antecedenten van postnatale CMV-infectie), en deze vergeleken met 37 gezonde controles. De auteurs zijn tot het besluit gekomen dat de neurobiologische gevolgen op lange termijn van een postnatale CMV-infectie opspoorbaar zijn bij oudere kinderen en bij adolescenten die prematuur geboren zijn. De beelden wijzen op een hogere compenserende hersenactiviteit bij de uitvoering van een cognitieve taak bij in het verleden besmette prematuren. Hun resultaten sluiten aan bij recente studies en tonen aan dat het schadelijke effect van deze infectie klinisch kan worden waargenomen (Bevot et al., Goelz et al.). Ze leveren het eerste bewijs dat dat soort neurobiologische gevolgen kan worden gedetecteerd, zelfs bij kinderen en adolescenten met een normale intelligentie quotiënt (IQ).(39) Een ander team heeft MRI-scans van de hersenen geanalyseerd van kinderen die zijn geboren vóór 32 WZL, met een antecedent van postnatale CMV-infectie. De beelden werden genomen op 40 WZL. Ze hebben micro-structurele wijzigingen vastgesteld in de witte occipitale substantie, maar er was geen verschil zichtbaar bij de evaluatie van de neuro-ontwikkeling op 16 maanden gecorrigeerde leeftijd.(40)
Tabel 1: Overzicht van de studies naar de langetermijngevolgen van de via de MM overgedragen postnatale CMV-infectie
Preventie
Hamprecht heeft in 2001 een cijfer van 37% gepubliceerd(15) inzake postnatale CMV-overdracht door rauwe MM bij prematuren van <32 WZL en/of <1500g. Dit cijfer schommelt echter sterk al naargelang de studies.
Voor de virale inactivatie in de MM kunnen verschillende technieken worden gebruikt. De “holder pasteurisation” (62,5°C, 30 min) en “short-term pasteurisation” (72°C, 5-10 sec) worden als de meest efficiënte methodes beschouwd om het virus uit de MM te elimineren.(20, 41) Deze technieken hebben evenwel een impact op de kwaliteit van de melk.
Door het invriezen op -20°C tijdens 72 uur worden de immunologische en nutritieve eigenschappen van de MM bewaard en daalt de infectiviteit. Het virus wordt wel niet volledig geïnactiveerd (26). Bij een geringe virale belasting evenwel, met name aan het begin en aan het einde van de reactiveringsperiode, zou het invriezen het virus volledig kunnen inactiveren.(41, 42) In de meta-analyse van Lanzieri et al, bedroeg het infectiecijfer bij kinderen die met diepgevroren melk waren gevoed 13% tegenover 19% bij zij die met rauwe melk waren gevoed. Het percentage “sepsis like syndrom” dat aan CMV wordt toegeschreven daarentegen, was voor beide groepen vergelijkbaar.(27) Andere studies hebben het over een minder ernstige verworven infectie, ondanks het invriezen van de MM.(8, 43)
Discussie
De gevolgen op korte termijn zijn uiteenlopend, van asymptomatisch tot ernstig. Een postnatale CMV-infectie is vooral ernstig, wanneer ze samenvalt met een reeds bestaande aandoening. Een belastende omstandigheid zoals een bronchodysplasie is evenwel vaak onbekendop het ogenblik dat moet worden beslist de melk van geïmmuniseerde moeders tegen CMV al dan niet te pasteuriseren. De infectie verdwijnt echter meestal spontaan En tot op de dag van vandaag bestaat wat dat betreft geen enkele therapeutische eensgezindheid.
De studies over de toekomst op lange termijn van die kinderen is stof voor debat over de noodzaak om de overdracht van CMV via MM bij de prematuur te vermijden. De weinige studies die zijn uitgevoerd hebben betrekking op een gering aantal patiënten en slechts twee daarvan hebben de kinderen gevolgd tot aan de schoolplichtige leeftijd. Bovendien zijn de meeste actuele gegevens afkomstig van het cohort van het centrum van Tübingen.(35-37, 39) Tenslotte zijn de groepen patiënten vaak weinig homogeen, waardoor het moeilijk is een onderscheid te maken tussen de gevolgen van de infectie en diegenen die met de hoge prematuriteit te maken hebben.
Bij het heel jonge kind konden de opvolgingsstudies geen neurologische of neurocognitieve gevolgen aantonen, terwijl er gevolgen worden gedetecteerd op de schoolplichtige leeftijd. De toekomst op 2,5 en 4 jaar die door Völlmer is gepubliceerd, wees niet op een verschil tussen de besmette patiënten en hun homogene controlegroep.(35) Bij de opvolging op de schoolplichtige leeftijd, waren de cognitieve functies toch geringer dan bij de controlegroep, vooral dan bij prematuren die geboren waren vóór 30 WZL (37). De resultaten van de studie van Dorn et al. (39), waarin MRI-scans zijn uitgevoerd bij kinderen van datzelfde cohort, leveren bijkomende argumenten op voor de schadelijke gevolgen op lange termijn van een postnatale CMV-infectie.
De voorspellende waarde van de echografische tekens die vaak worden vastgesteld bij een postnatale, zelf asymptomatische CMV-infectie, is tot op vandaag niet bekend. Er wordt dan ook met spanning uitgekeken naar de resultaten van de studie van Nijman (38) (opvolging op 5 jaar).
De aanbevelingen inzake voeding van prematuren die geboren zijn uit tegen CMV geïmmuniseerde moeders verschillen van land tot land. De AAP spreekt zich er niet over uit en beveelt rauwe MM van de eigen moeder aan voor de voeding van de prematuur. Ze raadt wel aan voorzichtig te zijn voor prematuren <32 WZL of <1500g die geboren zijn uit tegen CMV geïmmuniseerde moeders.(44)
In Zweden wordt de melk voor pasgeborenen van <32 WZL ingevroren. Het Voedingscomité van de Austrian Society of Pediatric and Adolescent Medecine raadt aan de status van alle moeders te bepalen en in geval van aanwezigheid van anti-CMV IgG-antistoffen, te opteren voor “holder pasteurisation” of invriezing tot 35 WZL, ook voor het colostrum. (6, 9, 45) In Duitsland wordt voor alle moeders die bevallen zijn van een prematuur < 33 WZL en/of <1500g, de CMV-status bepaald. In geval van positieve serologie, worden de ouders ingelicht en kan de melk na hun toestemming, rauw of na invriezing worden toegediend.(45, 46) In Frankrijk gebeurt pasteurisatie systematisch bij prematuren <32 WZL en/of <1500g geboren uit geïmmuniseerde moeders. (6, 45) In geval van positieve serologie bij de moeder, wordt de MM de eerste vijf dagen (colostrum) rauw toegediend en daarna gepasteuriseerd voor pasgeborenen van minder dan 30 WZL en dit tot aan 34 WZL.
Conclusie
De meeste studies over de gevolgen op korte en lange termijn mogen dan al geruststellend zijn, die over de opvolging op de schoolplichtige leeftijd en met name de recente gegevens over de radiologische opvolging van postnatale CMV-infecties zijn dat al veel minder. Vervolgonderzoek waarbij meer patiënten zijn betrokken, en dat zich vooral richt op prematuren <30 weken en/of <1000g, en waarbij de klinische opvolging wordt verlengd tot aan de schoolplichtige leeftijd, is noodzakelijk om hun resultaten te valideren.
Belangrijk is ook om een beter inzicht te krijgen in de mechanismen van virale reactivatie en om de risicopopulatie en –periode nauwkeuriger in kaart te brengen. Zo wordt een nodeloze behandeling van de melk vermeden. Een geïndividualiseerde aanpak op basis van de risicofactoren en de gezondheidstoestand van de pasgeborene zou ideaal zijn om het infectiegevaar te minimaliseren en tegelijk de positieve eigenschappen van de rauwe melk te bewaren.
In afwachting dat nieuwe gegevens worden gepubliceerd, is voorzichtigheid geboden. Bij een beslissing om de risicomelk van de moeder, na overleg met de ouders, niet te pasteuriseren, is een voorafgaande toestemming vereist.
Bibliografie
- Munro SC, Hall B, Whybin LR, Leader L, Robertson P, Maine GT, et al. Diagnosis of and screening for cytomegalovirus infection in pregnant women. Journal of clinical microbiology. 2005;43(9):4713-8.
- Nassetta L, Kimberlin D, Whitley R. Treatment of congenital cytomegalovirus infection: implications for future therapeutic strategies. The Journal of antimicrobial chemotherapy. 2009;63(5):862-7.
- Cannon MJ, Schmid DS, Hyde TB. Review of cytomegalovirus seroprevalence and demographic characteristics associated with infection. Reviews in medical virology. 2010;20(4):202-13.
- Bate SL, Dollard SC, Cannon MJ. Cytomegalovirus seroprevalence in the United States: the national health and nutrition examination surveys, 1988-2004. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America. 2010;50(11):1439-47.
- Dollard SC, Grosse SD, Ross DS. New estimates of the prevalence of neurological and sensory sequelae and mortality associated with congenital cytomegalovirus infection. Reviews in medical virology. 2007;17(5):355-63.
- Kurath S, Halwachs-Baumann G, Muller W, Resch B. Transmission of cytomegalovirus via breast milk to the prematurely born infant: a systematic review. Clinical microbiology and infection : the official publication of the European Society of Clinical Microbiology and Infectious Diseases. 2010;16(8):1172-8.
- Yeager AS, Palumbo PE, Malachowski N, Ariagno RL, Stevenson DK. Sequelae of maternally derived cytomegalovirus infections in premature infants. The Journal of pediatrics. 1983;102(6):918-22.
- Bryant P, Morley C, Garland S, Curtis N. Cytomegalovirus transmission from breast milk in premature babies: does it matter? Archives of disease in childhood Fetal and neonatal edition. 2002;87(2):F75-7.
- Lombardi G, Garofoli F, Manzoni P, Stronati M. Breast milk-acquired cytomegalovirus infection in very low birth weight infants. The journal of maternal-fetal & neonatal medicine : the official journal of the European Association of Perinatal Medicine, the Federation of Asia and Oceania Perinatal Societies, the International Society of Perinatal Obstet. 2012;25 Suppl 3:57-62.
- Clarke NM, May JT. Effect of antimicrobial factors in human milk on rhinoviruses and milk-borne cytomegalovirus in vitro. Journal of medical microbiology. 2000;49(8):719-23.
- Hamprecht K, Maschmann J, Jahn G, Poets CF, Goelz R. Cytomegalovirus transmission to preterm infants during lactation. Journal of clinical virology : the official publication of the Pan American Society for Clinical Virology. 2008;41(3):198-205.
- Maschmann J, Hamprecht K, Dietz K, Jahn G, Speer CP. Cytomegalovirus infection of extremely low-birth weight infants via breast milk. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America. 2001;33(12):1998-2003.
- Vochem M, Hamprecht K, Jahn G, Speer CP. Transmission of cytomegalovirus to preterm infants through breast milk. The Pediatric infectious disease journal. 1998;17(1):53-8.
- van der Strate BW, Harmsen MC, Schafer P, Swart PJ, The TH, Jahn G, et al. Viral load in breast milk correlates with transmission of human cytomegalovirus to preterm neonates, but lactoferrin concentrations do not. Clinical and diagnostic laboratory immunology. 2001;8(4):818-21.
- Hamprecht K, Maschmann J, Vochem M, Dietz K, Speer CP, Jahn G. Epidemiology of transmission of cytomegalovirus from mother to preterm infant by breastfeeding. Lancet. 2001;357(9255):513-8.
- Numazaki K, Chiba S, Asanuma H. Transmission of cytomegalovirus. Lancet. 2001;357(9270):1799-800.
- Hamprecht K, Witzel S, Maschmann J, Dietz K, Baumeister A, Mikeler E, et al. Rapid detection and quantification of cell free cytomegalovirus by a high-speed centrifugation-based microculture assay: comparison to longitudinally analyzed viral DNA load and pp67 late transcript during lactation. Journal of clinical virology : the official publication of the Pan American Society for Clinical Virology. 2003;28(3):303-16.
- Stagno S, Brasfield DM, Brown MB, Cassell GH, Pifer LL, Whitley RJ, et al. Infant pneumonitis associated with cytomegalovirus, Chlamydia, Pneumocystis, and Ureaplasma: a prospective study. Pediatrics. 1981;68(3):322-9.
- Hamele M, Flanagan R, Loomis CA, Stevens T, Fairchok MP. Severe morbidity and mortality with breast milk associated cytomegalovirus infection. The Pediatric infectious disease journal. 2010;29(1):84-6.
- Hamprecht K, Goelz R, Maschmann J. Breast milk and cytomegalovirus infection in preterm infants. Early human development. 2005;81(12):989-96.
- Fischer C, Meylan P, Bickle Graz M, Gudinchet F, Vaudaux B, Berger C, et al. Severe postnatally acquired cytomegalovirus infection presenting with colitis, pneumonitis and sepsis-like syndrome in an extremely low birthweight infant. Neonatology. 2010;97(4):339-45.
- Knorr B, Kessler U, Poschl J, Fickenscher H, Linderkamp O. A haemophagocytic lymphohistiocytosis (HLH)-like picture following breastmilk transmitted cytomegalovirus infection in a preterm infant. Scandinavian journal of infectious diseases. 2007;39(2):173-6.
- Hancox JG, Shetty AK, Sangueza OP, Yosipovitch G. Perineal ulcers in an infant: an unusual presentation of postnatal cytomegalovirus infection. Journal of the American Academy of Dermatology. 2006;54(3):536-9.
- Cheong JL, Cowan FM, Modi N. Gastrointestinal manifestations of postnatal cytomegalovirus infection in infants admitted to a neonatal intensive care unit over a five year period. Archives of disease in childhood Fetal and neonatal edition. 2004;89(4):F367-9.
- Neuberger P, Hamprecht K, Vochem M, Maschmann J, Speer CP, Jahn G, et al. Case-control study of symptoms and neonatal outcome of human milk-transmitted cytomegalovirus infection in premature infants. The Journal of pediatrics. 2006;148(3):326-31.
- Capretti MG, Lanari M, Lazzarotto T, Gabrielli L, Pignatelli S, Corvaglia L, et al. Very low birth weight infants born to cytomegalovirus-seropositive mothers fed with their mother’s milk: a prospective study. The Journal of pediatrics. 2009;154(6):842-8.
- Lanzieri TM, Dollard SC, Josephson CD, Schmid DS, Bialek SR. Breast milk-acquired cytomegalovirus infection and disease in VLBW and premature infants. Pediatrics. 2013;131(6):e1937-45.
- Paryani SG, Yeager AS, Hosford-Dunn H, Johnson SJ, Malachowski N, Ariagno RL, et al. Sequelae of acquired cytomegalovirus infection in premature and sick term infants. The Journal of pediatrics. 1985;107(3):451-6.
- Johnson SJ, Hosford-Dunn H, Paryani S, Yeager A, Malachowski N. Prevalence of sensorineural hearing loss in premature and sick term infants with perinatally acquired cytomegalovirus infection. Ear and hearing. 1986;7(5):325-7.
- Nijman J, van Zanten BG, de Waard AK, Koopman-Esseboom C, de Vries LS, Verboon-Maciolek MA. Hearing in preterm infants with postnatally acquired cytomegalovirus infection. The Pediatric infectious disease journal. 2012;31(10):1082-4.
- Jim WT, Shu CH, Chiu NC, Kao HA, Hung HY, Chang JH, et al. Transmission of cytomegalovirus from mothers to preterm infants by breast milk. The Pediatric infectious disease journal. 2004;23(9):848-51.
- Miron D, Brosilow S, Felszer K, Reich D, Halle D, Wachtel D, et al. Incidence and clinical manifestations of breast milk-acquired Cytomegalovirus infection in low birth weight infants. Journal of perinatology : official journal of the California Perinatal Association. 2005;25(5):299-303.
- Turner KM, Lee HC, Boppana SB, Carlo WA, Randolph DA. Incidence and impact of CMV infection in very low birth weight infants. Pediatrics. 2014;133(3):e609-15.
- Mehler K, Oberthuer A, Lang-Roth R, Kribs A. High rate of symptomatic cytomegalovirus infection in extremely low gestational age preterm infants of 22-24 weeks’ gestation after transmission via breast milk. Neonatology. 2014;105(1):27-32.
- Vollmer B, Seibold-Weiger K, Schmitz-Salue C, Hamprecht K, Goelz R, Krageloh-Mann I, et al. Postnatally acquired cytomegalovirus infection via breast milk: effects on hearing and development in preterm infants. The Pediatric infectious disease journal. 2004;23(4):322-7.
- Bevot A, Hamprecht K, Krageloh-Mann I, Brosch S, Goelz R, Vollmer B. Long-term outcome in preterm children with human cytomegalovirus infection transmitted via breast milk. Acta paediatrica. 2012;101(4):e167-72.
- Goelz R, Meisner C, Bevot A, Hamprecht K, Kraegeloh-Mann I, Poets CF. Long-term cognitive and neurological outcome of preterm infants with postnatally acquired CMV infection through breast milk. Archives of disease in childhood Fetal and neonatal edition. 2013;98(5):F430-3.
- Nijman J, de Vries LS, Koopman-Esseboom C, Uiterwaal CS, van Loon AM, Verboon-Maciolek MA. Postnatally acquired cytomegalovirus infection in preterm infants: a prospective study on risk factors and cranial ultrasound findings. Archives of disease in childhood Fetal and neonatal edition. 2012;97(4):F259-63.
- Dorn M, Lidzba K, Bevot A, Goelz R, Hauser TK, Wilke M. Long-term neurobiological consequences of early postnatal hCMV-infection in former preterms: a functional MRI study. Human brain mapping. 2014;35(6):2594-606.
- Nijman J, Gunkel J, de Vries LS, van Kooij BJ, van Haastert IC, Benders MJ, et al. Reduced occipital fractional anisotropy on cerebral diffusion tensor imaging in preterm infants with postnatally acquired cytomegalovirus infection. Neonatology. 2013;104(2):143-50.
- Hamprecht K, Maschmann J, Muller D, Dietz K, Besenthal I, Goelz R, et al. Cytomegalovirus (CMV) inactivation in breast milk: reassessment of pasteurization and freeze-thawing. Pediatric research. 2004;56(4):529-35.
- Maschmann J, Hamprecht K, Weissbrich B, Dietz K, Jahn G, Speer CP. Freeze-thawing of breast milk does not prevent cytomegalovirus transmission to a preterm infant. Archives of disease in childhood Fetal and neonatal edition. 2006;91(4):F288-90.
- Sharland M, Khare M, Bedford-Russell A. Prevention of postnatal cytomegalovirus infection in preterm infants. Archives of disease in childhood Fetal and neonatal edition. 2002;86(2):F140.
- Gartner LM, Morton J, Lawrence RA, Naylor AJ, O’Hare D, Schanler RJ, et al. Breastfeeding and the use of human milk. Pediatrics. 2005;115(2):496-506.
- Buxmann H, Falk M, Goelz R, Hamprecht K, Poets CF, Schloesser RL. Feeding of very low birth weight infants born to HCMV-seropositive mothers in Germany, Austria and Switzerland. Acta paediatrica. 2010;99(12):1819-23.
- Goelz R, Hamprecht K, Vochem M, Maschmann J, Speer CP, Jahn G, et al. [Breast feeding of very preterm infants of HCMV-seropositive mothers]. Zeitschrift fur Geburtshilfe und Neonatologie. 2004;208(3):118-21.
Nieuwigheden
Wetenschappelijke agenda
- maart 2024
-
28/03
BICS Symposium
- april 2024
-
van 8/04 tot 11/04 || in Edinburgh
The Microbiology Society Annual Conference
-
van 23/04 tot 24/04 || in Birmingham
Infection and Prevention Control (IPC)
-
van 27/04 tot 30/04 || in Barcelona
34th European Congress of Clinical Microbiology and infectious diseases
- mei 2024
-
van 16/05 tot 17/05 || in Louvain-La-Neuve
18ème Rencontre Internationale Francophone des Infirmiers et Infirmières (RIF)



