Preventie van centrale katheter gerelateerde infecties: naar een nul-tolerantie?
Inleiding
Bloedstroominfecties (BSI) zijn een belangrijke oorzaak van morbiditeit en mortaliteit. De diagnose en registratie van deze infectie vertrekt vanuit een positieve bloedkweek. In België beschikken we niet over betrouwbare incidentiecijfers voor alle bloedstroominfecties maar in 2013 bedroeg de gemiddelde incidentie voor BSI die ontstaan zijn in het ziekenhuis 5,9/1000 opnames. [http://www.nsih.be/] Bloedstroominfecties kunnen onderverdeeld worden op basis van de (zorg)omgeving waarin ze voorkomen. Een aantal parameters waaronder de voortschrijdende veroudering van de bevolking, de veranderende gezondheidszorg en de steeds uitbreidende globalisatie maken dat de klassieke epidemiologische onderverdeling in ‘community onset’ BSI en ‘hospital onset’ BSI steeds minder voldoet. Binnen de groep van community onset infecties kan een behoorlijk deel immers worden toegewezen aan patiënten in chronische zorgomgevingen zoals thuiszorg, verblijf in een woonzorgcentrum of dagverblijf. We noemen deze infecties dan beter ‘healthcare-associated’.[1]
Bloedstroominfecties kunnen ook worden onderverdeeld op basis van de infectieuze focus waaruit ze ontstaan. Voor bloedstroominfecties die ontstaan zijn in het ziekenhuis secundair op een eerdere infectiefocus scoren pulmonaire en urinaire oorzaken hoog, gevolgd door postoperatieve wondinfecties. Van een aantal bloedstroominfecties blijft de oorsprong ongekend. Een deel hiervan kan zeker toegewezen worden aan translocatie van bacteriën naar de bloedbaan via beschadigde slijmvliezen (MBI-LCBSI). Deze situatie komt voor bij immuun gecompromitteerde patiënten zoals transplantatie patiënten en patiënten die met chemotherapie of radiotherapie behandeld worden.[2] De nieuwe definities worden samengevat in Tabel 1. Ze laten ons toe om een meer verfijnde registratie van bloedstroominfecties op te bouwen en op die manier beter zicht te krijgen op het deel van de infecties dat vermijdbaar zou kunnen zijn.
Bloedstroominfecties die ontstaan in onze ziekenhuizen behoren tot het deel van zorginfecties dat beïnvloedbaar is door onze zorgpraktijk en attitude. De reductie die door infectiepreventie kan bekomen worden, is significant en dit des te meer omdat het mortaliteitsrisico van deze infecties hoog is. Preventie van bloedstroominfecties veroorzaakt door centrale katheters behoort tot deze entiteit en verdient dus ruim de aandacht van elke zorginstelling en iedere gezondheidswerker.
In dit artikel beschrijven wij onze ervaring als deelnemer aan een Europese studie die bloedstroominfecties veroorzaakt door een centrale katheter wil voorkomen door het gebruik van zorgbundels. We leggen in de beschrijving de focus op de gedragsverandering die vereist is om dit project te laten slagen. We schetsen de barrières en de opportuniteiten die we tijdens de studie ondervonden.
Materiaal en methoden
De PROHIBIT studie (PRevention Of Hospital Infections By Intervention and Training) werd opgezet binnen de Europese Unie (EU). Het project behoort tot het Framework 7 Specific Targeted Research Projects (STReP) van de EU. (http://ec.europa.eu/research/fp7) De nationale Europese coördinatiecentra die ook EARS-net onder supervisie hebben, in België het WIV-ISP, informeerden in 2010 alle acute ziekenhuizen over dit EU project. Geïnteresseerde ziekenhuizen konden een applicatiedossier indienen bij de nationale EU-coördinator.
Bij de start van de PROHIBIT studie in 2010 bedraagt de gemiddelde incidentie van bloedstroominfecties, ontstaan in het ziekenhuis, 7,5/10 000 patiëntendagen in België. Met een gemiddelde incidentie van 3,5/10 000 patiëntendagen is het aandeel van secundaire BSI met focus vanuit een orgaanstelsel, hierin het hoogst. Het aandeel van centrale katheter gerelateerde infecties (CR-BSI) is lager en meer wisselend per ziekenhuis maar bedraagt gemiddeld 1, 4/10 000 patiëntendagen. Bloedstroominfecties van ongekende oorsprong hebben in 2010 een incidentie van 2,6/10 000 patiëntendagen. [http://www.nsih.be/] AZ Sint-Lucas Gent is een secundair ziekenhuis met 805 bedden en een gemiddelde opname duur van 6,1 dagen. De gemiddelde opname duur op intensieve zorg is 4,1 dagen. De incidentie van CR-BSI in het ziekenhuis bedraagt 1,8/10 000 patiëntendagen bij het begin van de studie.
PROHIBIT is een studie met zes onderdelen. Twee delen hiervan, de interventie studie en de ‘in depth’ module, dienden te worden uitgevoerd op de afdelingen intensieve zorg in 15 over de EU verspreide ziekenhuizen. In de interventie studie werd de effectiviteit van bundel strategieën op de incidentie van CR-BSI op de afdeling intensieve zorg gemeten. In dit deel waren ook ‘train the trainer’ modules voorzien over handhygiëne en de plaatsing van een centrale katheter. (www.carepractice.net) In de ‘in depth’ module werd bij een representatieve steekproef van studiecentra gepeild naar de succesfactoren en de barrières die kunnen optreden bij de implementatie van de bundel praktijken voor de preventie van CR-BSI.
Voor de studie werd de methodologie van ‘stepped wedge cluster randomisation’ gebruikt. Deze studiemethode is een speciale vorm van gerandomiseerd onderzoek waarbij een interventie op groepsniveau getrapt wordt ingevoerd. Het design kan worden gebruikt wanneer randomiseren op individueel niveau niet goed mogelijk is. In dit design wordt ook een controleperiode gebruikt: de tijd voordat de experimentele interventie in een cluster is ingevoerd. Dit type onderzoek is van een betere kwaliteit dan voor-na studies of punt prevalentie studies, maar het vergt ook een aanzienlijke investering aan tijd, geld en mensen. De PROHIBIT studie vergeleek de efficiëntie van 3 tactieken: handhygiëne, katheterbundel, of beide interventies samen. De studie werd sequentieel uitgerold op de afdelingen intensieve zorg van Europese acute ziekenhuizen. Er werd gestart in januari 2011 met een controle periode van 6 maanden waarin naast de meting van de handhygiëne compliantie via een gerandomiseerd, intensief systeem van observaties ook de katheterinfecties geregistreerd werden. Deze observaties en metingen liepen verder door gedurende het volledige traject. In juli 2011 werd ons ziekenhuis gerandomiseerd om de bundel voor katheterplaatsing toe te passen tot het einde van de studie in juni 2013. Met 3 nieuwe deelnemers per trimester kregen alle ziekenhuizen uiteindelijk een interventie toegewezen tegen juli 2012. Het AZ Sint Lucas Gent nam niet deel aan het ‘in depth’ gedeelte maar hield een dagboek (implementation log) bij waarin de uitvoering van de bundel werd gedocumenteerd. We deelden dit dagboek op regelmatige basis met de studiecoördinatoren.
Resultaten
De studie duurde 36 maanden. Uiteindelijk namen 14 ziekenhuizen uit 11 Europese landen (België, Griekenland, Ierland, Italië, Hongarije, Letland, Oostenrijk, Polen, Roemenië, Slovenië en Spanje) deel aan de studie. In het totaal werden 25 377 patiënten geïncludeerd met 35 894 katheters, 263 093 katheterdagen en 384 CR-BSI. Een reeds voor de studie vrij lage gemiddelde infectie ratio van 2,4 CR-BSI per 1000 katheterdagen werd verder gereduceerd tot 0,9 infecties per 1000 katheterdagen. [Figuur 1] Ziekenhuizen in landen met de laagste uitgaven aan gezondheidszorg hadden de hoogste basis infectiecijfers. De handhygiëne compliantie en de katheter insertie praktijk verbeterde bijna in elk centrum. Het gemiddelde handhygiëne compliantie cijfer bij de start van de studie was 49%. De verbetering in handhygiëne toepassing was het grootst in die ziekenhuizen die gerandomiseerd werden om enkel deze interventie toe te passen. In een aantal ziekenhuizen, waaronder Gent, die de katheterbundel kregen toegewezen, werd ook significante verbetering gemeten van handhygiëne toepassing. De verbetering van de katheter bundel toepassing was het grootst in centra die deze bundel kregen toegewezen al dan niet in combinatie met handhygiëne. Enkele centra die enkel handhygiëne moesten promoten, observeerden ook een lichte stijging in de bundeltoepassing voor katheterplaatsing. Over de verschillende onderdelen van de PROHIBIT studie werd gerapporteerd op congressen en in publicaties.[3] Een samenvatting van de volledige studie resultaten werd gepubliceerd op de CORDIS (Community Research and Development Information Service) website van de Europese commissie. [ http://cordis.europa.eu/result/rcn/158223_en.html]
Discussie
Eerder werd reeds aangetoond dat multimodale interventies bij katheter plaatsing en katheterzorg een duidelijke invloed kunnen hebben op de incidentie van CR-BSI op de afdeling intensieve zorg.[4] Een bundel voor katheter infectiepreventie omvat minstens de volgende parameters: maximale steriele barrière bij plaatsing van een katheter, vermijden van plaatsing van vena femoralis katheters, handhygiëne bij katheter zorg en katheter manipulatie, en dagelijkse bevraging van de indicatie voor behouden van de katheter.
Een recente systematische review en meta-analyse uit 2014 ging op zoek naar de meest effectieve interventies om CR-BSI te voorkomen. Zij kwamen tot de bevinding dat er wel degelijk zulke interventies bestaan en dat zorgbundels en checklists het best scoren.[5] Het hoofddoel van de PROHIBIT studie was niet om deze resultaten te bevestigen maar om de praktijk efficiëntie ervan na te gaan.
We werden geconfronteerd met enkele obstakels op ons studiepad nog voor de studie was begonnen. Het eerste obstakel was de Belgische privacy wetgeving die voor een interventionele studie schriftelijke toestemming van elke patiënt vereist die in de studie wordt opgenomen. [http://www.fagg-afmps.be/nl/] Dit is volledig terecht in echte interventionele studies. De PROHIBIT studie voert ook interventies uit maar het zijn handelingen die tot de GMP (Good Medical Practice) zouden moeten behoren in elke instelling. Het betreft hier gevalideerde processen die opgenomen zijn in (inter)nationale richtlijnen. Het is tevens een vereiste voor de studie dat zoveel mogelijk patiënten op de afdeling dezelfde zorgkwaliteit/bundel krijgen toegediend. Het verwerven van deze schriftelijke toestemmingen was bij wet enkel vereist in België, legde een enorme administratieve druk op de studie en zorgde soms voor onduidelijkheid bij de patiënt. Wij pleiten er dan ook voor dat commissies medische ethiek in de toekomst een zorgvuldige afweging van de ethische aspecten van het stepped-wedge design blijven behouden waarbij de patiënten en hun omgeving ruim geïnformeerd worden, maar waarbij schriftelijke toestemming op individueel niveau niet meer vereist is. Elke patiënt behoudt natuurlijk het recht om individueel te kiezen om niet deel te nemen aan de studie (opting out). Een tweede obstakel van de gebruikte methodologie is dat je als individueel ziekenhuis vroeg of (heel) laat kunt gerandomiseerd worden zodat de interventie soms slechts voor beperkte tijd kan worden uitgevoerd. Bij late randomisatie heb je veel minder tijd om de interventie te implementeren en, wanneer gewenst, te verankeren in de instelling.
Het lijkt logisch om de preventie van CR-BSI te concentreren op die afdelingen waar veel centrale katheters aanwezig zijn zoals intensieve zorg, haemato-oncologie, hemodialyse. Toch vormen afdelingen waar het aantal katheters veel kleiner is ook een reëel gevaar omdat de expertise van de medewerkers daar veel kleiner is. Op basis van de continue registratie van nosocomiale bloedstroominfecties in de NSIH (national surveillance of healthcare associated infections and antimicrobial resistance in Belgian hospitals, WIV-ISP) hadden wij enigszins zicht op de incidentie van CR-BSI in onze instelling. Daaruit bleek dat de basis incidentie voor het hele ziekenhuis laag tot gemiddeld bleek te liggen en dat een behoorlijk deel van de katheterinfecties zich voordeed buiten de afdeling intensieve zorgen. In overleg met de (zorg) directie en het team infectiepreventie, werd besloten om dit project op intensieve zorgen meteen ook aan te grijpen om ook op alle andere afdelingen de katheterzorg beter te registreren en te verbeteren.[6] De studie gaf ons de kans om procedures uitgebreid te herzien en instructiekaarten uit te werken. Dit is een basisvereiste voor kwaliteitsverbetering, maar er is meer nodig. Het creëren van een cultuur van toewijding en verantwoordelijkheid bij elke medewerker is veel belangrijker. Elke medewerker moet ervan overtuigd zijn dat CR-BSI een probleem is dat voor een deel kan vermeden worden. Je kan dat doen door directe en aanhoudende communicatie over prevalentie en incidentie van CR-BSI, door het aanbieden van uitgeschreven procedures en instructiekaarten. Je kan dit echter beter, efficiënter en met langduriger effect ook doen door elke medewerker op zijn werkplaats te betrekken in het proces.[7] Op die wijze kan je een netwerk van collega-‘peers’ opbouwen die door zelf correct te handelen een normatieve druk kunnen uitoefenen op wie dat nog niet doet. Kwaliteitsverbetering vereist ook leiderschap. Dit bleek heel duidelijk bij de vergelijking van de compliantie op de beide afdelingen waar centrale katheters worden geplaatst. De afdeling intensieve zorg werd met ondersteuning van artsen-intensivisten en hoofdverpleegkundigen een echt team met expertise en alertheid voor plaatsing en zorg van elke katheter. Op de operatieafdeling lukte dit, onder impuls van de studieverpleegkundige, voor een deel tijdens de studie maar verdween het effect snel nadien.
Multimodale interventies hebben geen harde eindpunten. De resultaten van de studie bewijzen dat ziekenhuizen naast de verplichte interventie ook de kwaliteit verbeteren van processen die ermee verbonden zijn. De studiecoördinatoren waren zich daarvan zeer bewust en hebben, ook om ethische redenen, steeds ruimte gelaten voor deze lokale, parallelle verbeteracties. Door de ‘in depth’ module en de dagboeken werd weer meer inzicht verworven in de dynamiek van multimodale strategieën en werd bevestigd dat deze aanpak wel degelijk uitvoerbaar is in Europa.[8] In alle ziekenhuizen bleek steeds weer dat een combinatie van factoren tot verbetering van de kwaliteit leidde. Individuen met expertise, in een gerespecteerde positie of in staat om bruggen te slaan, blijven zeer belangrijk in een verbeterproces. Daarnaast blijkt financiële ondersteuning om een projectcoördinator te installeren onontbeerlijk. De ondersteuning door een ervaren team infectiepreventie bleek ook sterk faciliterend te zijn.
Uit de studie resultaten kan een visie en missie voor opinie- en beleidsmakers worden gedistilleerd. Wij zijn daar, als deelnemer aan PROHIBIT, alvast mee gestart in onze eigen instelling.
Referenties
1. Laupland K, Church D. Population based epidemiology and microbiology of community onset bloodstream infections. Clin Microbiol Rev 2014; 27(4):647-664.
2. Steinberg J, Coffin S. Improving the Central Line–Associated Bloodstream Infection Surveillance Definition: A Work in Progress. Infection Control Hospital Epidemiol 2013; 34(8):769-776.
3. van der Kooi T, Wolkewitz M, van Benthem B et al. Prohibit (preventing hospital-acquired infections by intervention and training): preliminary results of a European multi-center study on the effectiveness of a hand hygiene campaign and a central venous catheter bundle. Antimicrob Resist Infect Control 2013; 2(Suppl 1):O83.
4. Pronovost P, Needham D, Berenholtz S et al. An Intervention to Decrease Catheter-Related Bloodstream Infections in the ICU. N Engl J Med 2006; 355:2725-2732.
5. Blot K, Bergs J, Vogelaers D et al. Prevention of central line-associated bloodstream infections through quality improvement interventions: a systematic review and meta-analysis. Clin Infect Dis 2014; 59(1):96-105.
6. Zingg W, Huttner B, Sax H. Assessing the Burden of Healthcare-Associated Infections through Prevalence Studies: What Is the Best Method? Infection Control Hospital Epidemiol 2014; 35 (6):674-684
7. Zingg W, Walder B, Pittet D. Prevention of catheter-related infection: toward zero risk? Curr Opin Infect Dis 2011; 24:377-384
8. Sax H, Clack L, Touveneau S et al. Implementation of infection control best practice in intensive care units throughout Europe: a mixed-method evaluation study. Implement Sci 2013; 8(24):8:24
Tabel1: Gehanteerde definities van de Europese PROHIBIT studie naar de doeltreffendheid van bundle care als preventie voor bloedstroominfecties in acute ziekenhuizen.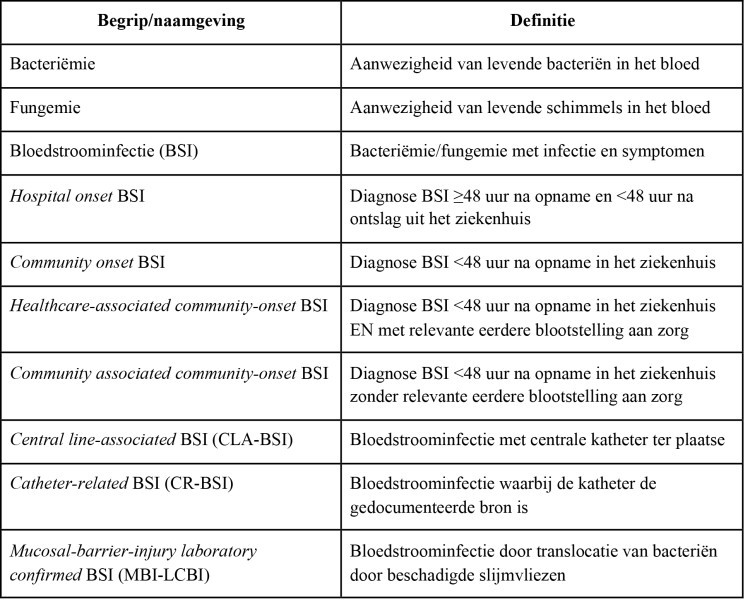
Figuur 1: Vergelijkende grafiek van incidentie van katheter-gerelateerde bloedstroominfecties (CRBSI) per 1000 katheterdagen voor en na een bundle care interventie, PROHIBIT studie (14 ziekenhuizen uit 11 Europese landen).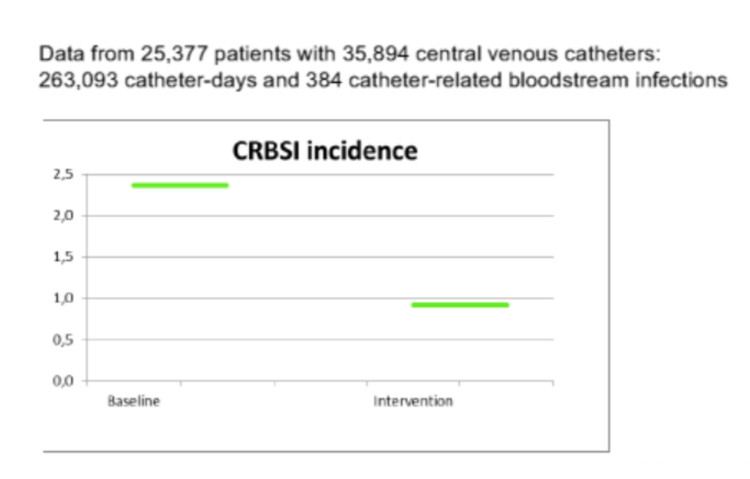
Nieuwigheden
Wetenschappelijke agenda
- oktober 2024
-
van 16/10 tot 20/10 || in Los Angeles
SHEA ID week. A joint meeting of IDSA, SHEA, HIVMA, PIDS and SIDP
- november 2024
-
van 20/11 tot 22/11 || in Liverpool
Healthcare infection society
- april 2025
-
van 11/04 tot 15/04 || in Wenen
Congrès de l’ European Society of Clinical Microbiology and Infectious Diseases (ESCMID)
- juni 2025
-
van 4/06 tot 6/06 || in Marseille
35ème Congrès National de la Société Française d’Hygiène Hospitalière (SF2H)
-
van 17/06 tot 18/06 || in Londen
HIS congres (Healthcare Infection Society)



