Geïmporteerde carbapenemase-producerende Enterobacteriaceae: de Belgische context

De toegenomen mobiliteit van de wereldbevolking draagt bij tot een verhoogd risico voor import en verspreiding van carbapenemase-producerende Enterobacteriaceae (CPE) in zorginstellingen in België via personen die in het buitenland verbleven hebben en er al-dan-niet in een ziekenhuis opgenomen werden.
1-Probleemschets
Sinds de opstart van de epidemiologische surveillance van CPE in België, in januari 2012, waren slechts 12% van al de gerapporteerde CPE-gevallen gerelateerd aan een verblijf in het buitenland (66 van de 566 gevallen). Screeningspraktijken beperkt tot deze risicogroep volstaan dus niet langer om verdere verspreiding van CPE in ons land te voorkomen.
Toch is waakzaamheid geboden tegenover deze risicogroep zoals ook blijkt uit de resultaten van de recent gepubliceerde VOYAG-R studie(1). De auteurs van deze studie verrichten onderzoek naar het risico voor het verwerven van CPE en van extended spectrum beta-lactamase producerende enterobacteriën (ESBLE) bij 574 reizigers na terugkeer van hun reis naar het buitenland (Amerika: n=183 reizigers; Afrika: n=195, Midden-Oosten et Zuidoost-Azië: n=196 waarvan 57 met een verblijf in India). Personen die naar deze continenten gereisd hadden vertoonden een verhoogd risico voor het verwerven van CPE indien ze tijdens hun buitenlands verblijf in een ziekenhuis hadden verbleven of bij medische repatriëring, maar zelfs in afwezigheid van rechtstreeks contact met gezondheidszorg in deze regio.
CPE werd geïdentificeerd bij 3 van de 57 (5%) Indiareizigers na hun terugkeer in Frankrijk (twee patiënten met E. coli type OXA-181[1] en een patiënt met E. coli type New-Delhi metallo-bêta-lactamase 1 (NDM-1). Tijdens hun verblijf in India had géén van deze drie reizigers contact gehad met een zorginstelling. Controlekweken uitgevoerd bij deze drie personen na hun terugkeer in Frankrijk, toonden aan dat het darmdragerschap van CPE van relatief korte duur was (maximum 3 maanden).
Waarschijnlijk dragen de ongunstige sanitaire en hygiënische omstandigheden (besmetting van de omgeving, van voeding en water) en het ongecontroleerde antibioticagebruik in India bij tot het toegenomen risico voor het verwerven van CPE en ESBLE bij reizen in dit land, zelfs indien geen van deze reizigers een antibioticabehandeling gekregen had tijdens hun verblijf.
Voor ESBLE werd het verband met reizen naar het buitenland al langer aangetoond(2-6). Volgens de verschillende studies varieert de proportie ESBLE-dragers onder reizigers van 5 tot 85% al naar gelang de bezochte landen(3-6).
Een Zweedse studie uitgevoerd in 2008-2009(5) toont aan dat het verwerven van ESBLE tijdens internationale reizen vaak voorkomt (30% van de reizigers) en dat de belangrijkste risicofactor voor ESBLE-kolonisatie het bezochte continent is. Het risiconiveau voor het verwerven van ESBLE is het hoogst na reizen naar het Indisch subcontinent: kolonisatie komt voor bij 71.4% van reizigers met deze reisbestemming (OR (odd’s ratio) 24.8, p<0.001), gevolgd door reizen naar Azië, India niet inbegrepen (44.8%, OR 8.63, p<0.001) en Noord-Afrika (43.3%, OR 4.94, p=0.002).
Deze bevindingen komen grotendeels overeen met resultaten van meerdere, voorheen uitgevoerde, gelijkaardige studies(3),(4),( 6),(7),(8),(9).
Naast de bezochte geografische zone waren ook het optreden van diarree of andere gastro-intestinale symptomen tijdens het verblijf en de leeftijd van de reiziger belangrijke risicofactoren voor het verwerven van ESBLE. Patiënten ouder dan 65 jaar hadden het hoogste risico voor ESBLE-verwerving. In de Zweedse studie werd geen CPE-verwerving aangetoond, maar de aangewende methode was vooral toegespitst op detectie van cefalosporine-resistente enterobacteriën. Waarschijnlijk werd hierdoor de aanwezigheid van carbapenemasen, vooral van het type OXA-48, onderschat.
Volgens de literatuur kan ESBLE dragerschap van lange duur zijn, 18% van de reizigers zijn nog asymptomatische drager 6 maanden na verwerving(6).
Import van CPE en andere reisgerelateerde MDRO (multidrug resistant organisms) geeft niet alleen aanleiding tot epidemieën maar veroorzaakt soms ook zeer ernstige, zelfs potentieel dodelijke infecties(10).
[1] OXA-181 : een mutant van OXA-48, typisch voor CPE-isolaten uit het Indisch subcontinent. OXA-181 komt vaak voor in associatie met een carbapenemase van het NDM type (of minder frequent van het VIM type).
2-Surveillanceresultaten: patiënten met reisgerelateerde CPE in Belgische zorginstellingen
Sinds de opstart van de actieve CPE-surveillance (januari 2012) in België werden in een tijdspanne van 24 maanden in totaal 890, met CPE gekoloniseerde of geïnfecteerde patiënten gerapporteerd. Anamnesegegevens met betrekking tot een verblijf/hospitalisatie in het buitenland ontbraken voor 324 patiënten (36%). Een buitenlands verblijf (al-dan-niet met hospitalisatie) werd slechts bij 12% (66 van de 566) van de gedocumenteerde CPE-gevallen gerapporteerd.
Van de 86 laboratoria die aan de surveillance hebben deelgenomen, hebben 23 ziekenhuislaboratoria en 1 privaat laboratorium minstens één reisgerelateerd CPE-geval gemeld. In de loop van de tweede helft van elk surveillancejaar werd telkens een hoger aantal reisgerelateerde CPE-gevallen gerapporteerd (verdubbeling) dan tijdens de eerste jaarhelft, waarschijnlijk onder invloed van het zomertoerisme (Figuur 1).
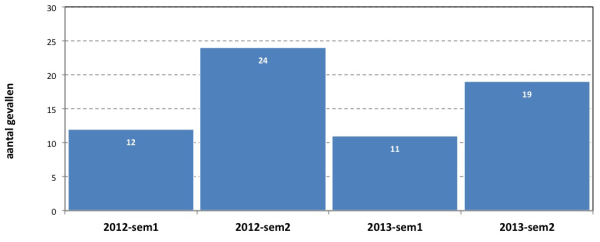
Figuur 1: Aantal reisgerelateerde CPE-gevallen per semester in België (n=66): 2012 – 2013
Het merendeel van de reisgerelateerde CPE-gevallen (62%, 41/66 gevallen) werd gemeld door 6 (van de in totaal 7) universitaire ziekenhuizen, terwijl algemene ziekenhuizen slechts 36% (24/66 gevallen) van de reisgerelateerde gevallen rapporteerden. Mogelijks worden patiënten vaker gerepatrieerd naar universitaire ziekenhuizen. De helft van de reisgerelateerde CPE-gevallen werden gemeld in regio Brussel: in totaal 33 gevallen, waarvan 26 meldingen door 3 Brusselse universitaire ziekenhuizen (Figuur 2).
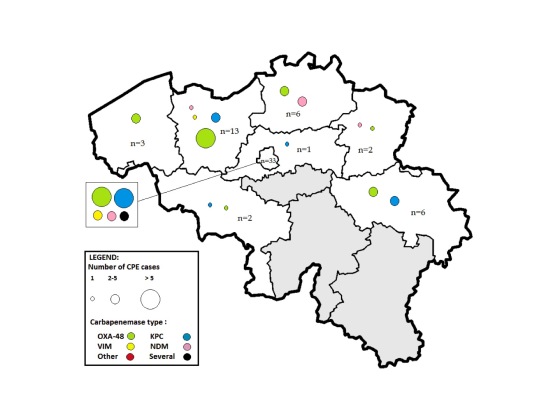
Figuur 2: Geografische verdeling van reisgerelateerde CPE-gevallen in België en verdeling van de verschillende types carbapenemasen, 2012-2013
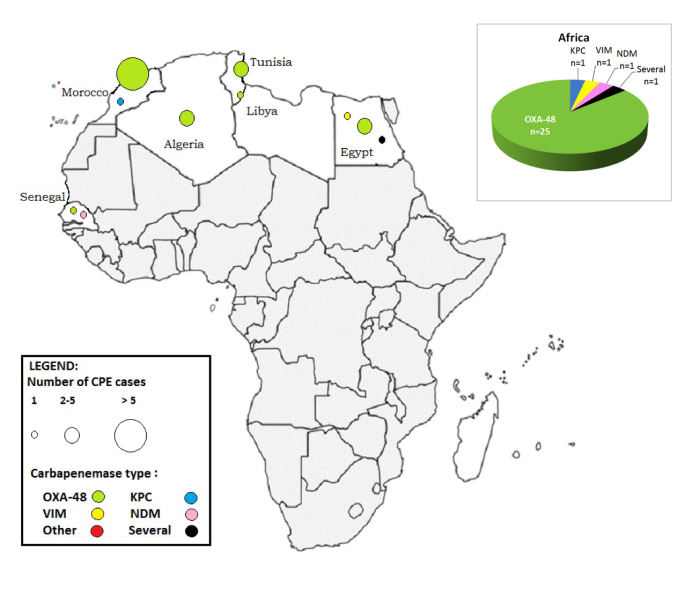
Het land van verblijf/hospitalisatie was gekend voor 65 patiënten met reisgerelateerde CPE. Negenentwintig patiënten (45%) hadden in een Afrikaans land verbleven, 18 (28%) in een Aziatisch land en 18 (28%) in een land van het Europees continent.
Afrika (n= 29)
De Noord-Afrikaanse landen (Marokko, Algerije, Tunesië, Libië, Egypte en Senegal) waren het meest frequent betrokken. De grote meerderheid van de CPE geïmporteerd uit Afrika produceerden carbapenemasen van het type OXA-48 (25 op een totaal van 29) (Figuur 3)
Figuur 3: CPE gerelateerd aan een verblijf/hospitalisatie in een Afrikaans land: aantal gevallen en type carbapenemasen per land, België 2012-2013
Azië (n= 18)
Uit Aziatische landen werden voornamelijk twee types carbapenemasen geïmporteerd (Figuur 4): type OXA-48, voornamelijk uit Turkije (n= 10) en type NDM uit India, Pakistan en Vietnam (n= 6).
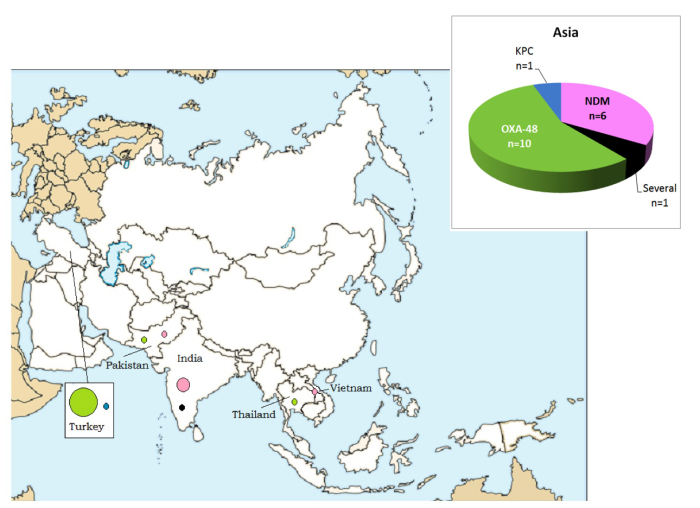
Figuur 4: CPE gerelateerd aan een verblijf/hospitalisatie in een Aziatisch land: aantal gevallen en type carbapenemasen per land, België 2012-2013
Europa (n= 18)
Bij reisgerelateerde CPE gevallen geïmporteerd uit een Europees land (Figuur 5) waren voornamelijk carbapenemasen van het type KPC (uit Griekenland en Italië, n=10) en van het type OXA-48 (Griekenland, n=4) betrokken.
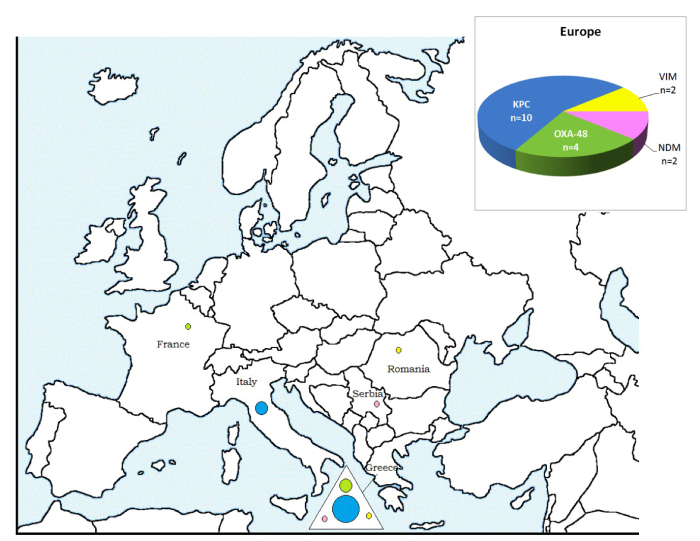
Figuur 5: CPE gerelateerd aan een verblijf/hospitalisatie in een Europees land: aantal gevallen en type carbapenemasen per land, België 2012-2013
3-Reflexie in verband met import van CPE en MDRO’s in België
3.1. Reisgerelateerde CPE gevallen: een onderschatte risicogroep
Ook al maakt het aantal patiënten met kolonisatie/infectie van CPE gerelateerd aan een verblijf en/of hospitalisatie in het buitenland slechts 12% uit van al de CPE-gevallen die in België gerapporteerd werden, toch is waakzaamheid tegenover deze specifieke risicogroep bijzonder aangewezen want de informatie met betrekking tot een reis of hospitalisatie in het buitenland ontbreekt voor één derde van al de gerapporteerde CPE-gevallen. De grootte van deze risicogroep wordt waarschijnlijk ruimschoots onderschat. Deze lacune is mogelijks deels toe te schrijven aan het type van surveillance, voornamelijk uitgaande van het microbiologisch laboratorium en minder vaak van de ziekenhuishygiëneteams of van de medische- en paramedische equipes die werkzaam zijn in ziekenhuisafdelingen. Idealiter wordt deze informatie rechtstreeks bij patiënten of hun verwanten verzameld. Een gedetailleerde reisanamnese met inbegrip van informatie over eventuele contacten met gezondheidszorgstructuren in het buitenland is cruciaal maar blijkt in de dagelijkse praktijk toch vaak moeilijk te verzamelen.
3.2. Gezien de globalisering van CPE is het gebruik van een lijst van endemische/epidemische landen niet langer zinvo
In zijn advies van 7 december 2011[1] raadt de Hoge Gezondheidsraad aan om CPE-dragerschap op te sporen bij elke patiënt overgebracht vanuit een ziekenhuis gelegen in een land waar CPE endemisch of epidemisch voorkomt. Terwijl het in 2011 nog zinvol was om een tabel op te stellen van landen met hoge endemiciteit voor CPE, is deze aanpak in het kader van de snelle globalisering van de epidemiologie van CPE momenteel voorbijgestreefd. Daarom is het aangewezen om elke ziekenhuistransfer vanuit het buitenland als risicovol te beschouwen voor het verwerven van een kolonisatie/infectie met CPE. Sterker nog, de hier boven aangehaalde studies tonen aan dat gezonde reizigers in bepaalde endemische gebieden waaronder het Indisch subcontinent gekoloniseerd kunnen worden met ESBLE en/of CPE, zelfs zonder voorafgaande contacten met de lokale gezondheidszorg en/of zonder rechtstreekse blootstelling aan antibioticabehandelingen tijdens hun verblijf.
3.3. De potentiële importbronnen van reisgerelateerde CPE zijn divers
3.3.1. De toename van de mobiliteit van de bevolking en van het wereldtoerisme
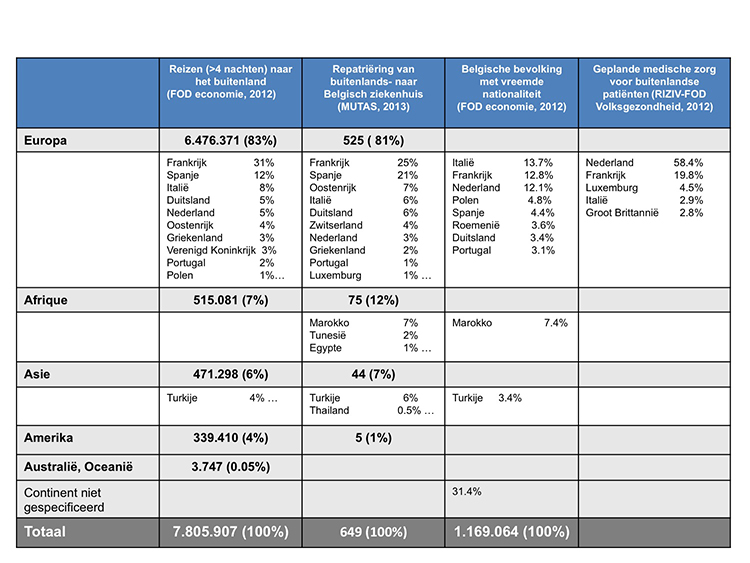
De grote mobiliteit van de wereldbevolking draagt in belangrijke mate bij tot de mobiliteit van resistente bacteriën en tot de globalisering van MDRO in de wereld(11). Omwille van haar centrale ligging binnen Europa, vormt België een druk doorgangsgebied zowel voor toerisme als voor professionele activiteiten (o.a. door de Europese- en Internationale instellingen). Anderzijds verblijven Belgen ook vaak in het buitenland. In 2012[2], werden in ons land 7.8 miljoen reizen (> 4 nachten) gerapporteerd van Belgen naar het buitenland: 6.5 miljoen reizen binnen Europa en 1.3 miljoen reizen buiten Europa (Tabel 1).
3.3.2. De migratiestromen in België
Ook migratiestromen spelen waarschijnlijk een rol in de globalisering van de antibioticaresistentie problematiek en in de verspreiding van MDRO tussen de verschillende continenten en landen(12).
In 2012 had 10.6% van de Belgische bevolking een buitenlandse nationaliteit[3] (in 2001: 8.4%). De belangrijkste landen van herkomst van Belgen met vreemde nationaliteit waren: Italië (13.7%), Frankrijk (12.8%), Nederland (12.1%) en Marokko (7.4%). Deze vier landen vertegenwoordigen samen de helft van de Belgische bevolking met vreemde nationaliteit. De overige landen van herkomst waren Polen (4.8%), Spanje (4.4%), Roemenië (3.6%), Duitsland (3.4%), Turkije (3.4%) en Portugal (3.1%). Het voorbije decennium kwam de grootste immigratiestroom uit Polen (verzevenvoudiging) en uit Roemenië (vertienvoudiging).
Net zoals Italië en Griekenland heeft ook Polen belangrijke CPE-epidemieën gekend, voornamelijk van het type KPC, waarschijnlijk geïmporteerd vanuit de Verenigde Staten(13).
Deze migranten met buitenlandse nationaliteit onderhouden vaak contacten en familiebanden in hun land van herkomst wat kan bijdragen tot een verhoogd risico voor grensoverschrijdende verspreiding van CPE en andere MDRO.
De grootste concentraties burgers met een buitenlandse nationaliteit komen voor in enkele gemeenten van de Brusselse agglomeratie en in de Brusselse rand, verder ook in de grootsteden (Antwerpen, Luik, Charleroi), in de grensstreken met onze buurlanden, in de universiteitssteden en rond de oude industriële as in Wallonië.
3.3.3. De medische repatriëring van een buitenlands- naar een Belgisch ziekenhuis
In België wordt de medische repatriëring van patiënten met complexe pathologieën of trauma’s, van een buitenlands- naar een Belgisch ziekenhuis, door diverse nationale/internationale organisaties (o.a. ziekenfondsen, reisverzekeraars) waargenomen. Hierdoor is het bijzonder moeilijk om een totaalbeeld te krijgen van het aantal naar Belgische zorginstellingen gerepatrieerde patiënten en van hun kenmerken. MUTAS[4], één van deze organisaties, rapporteerde voor 2013 in totaal 649 dringende medische repatriëringen van een buitenlands- naar een Belgisch ziekenhuis, waarvan 81% uit een Europees land, 12% uit Afrika en 7% uit Azië (Tabel 1).
Theoretisch is het vrij gemakkelijk om dragerschap van multiresistente bacteriën (waaronder CPE) op te sporen bij patiënten die rechtstreeks gerepatrieerd worden van een buitenlands- naar een Belgisch ziekenhuis als standaardprocedures systematisch ingevoerd worden door internationale organisaties die instaan voor deze medische repatriëring.
Het is echter een pak moeilijker om patiënten uit te filteren die na hun verblijf in het buitenland gewoon naar huis terugkeren alvorens in een Belgisch ziekenhuis opgenomen te worden en nog moeilijker om patiënten te selecteren die gewoon in endemische gebieden gereisd hebben zonder enige andere blootstelling aan risicofactoren (gezondheidszorg). De aandacht voor patiëntantecedenten ivm verblijf of gezondheidszorg in het buitenland (voorbije jaar) wordt steeds belangrijker maar is in de praktijk vaak moeilijk verwezenlijkbaar. Onze noorderburen met hun succesvol MRSA-beleid bewijzen echter dat het wel degelijk kan. Ook de eerstelijnszorg, m.n. huisartsen en thuiszorgverleners zouden extra informatie/vorming moeten krijgen m.b.t. (reisgerelateerde-) CPE, want dit resistentiemechanisme is momenteel nog onvoldoende gekend en wordt ten onrechte vaak als een louter “ziekenhuisproblematiek” beschouwd.
3.3.4. De geplande medische zorg voor buitenlandse patiënten in België
De kwaliteit en de toegankelijkheid van de gezondheidszorg in België is uitstekend.
Omwille van een gebrek aan middelen in sommige landen of een beperkte toegankelijkheid tot de gezondheidszorg, en het bestaan van lange wachtlijsten [5]–[6] stijgt sinds enkele jaren constant het aantal buitenlandse patiënten die gebruik maken van het medisch zorgaanbod in ons land.
Tussen 2004 en 2008 [7] nam het aantal patiënten dat in het buitenland woont en gehospitaliseerd wordt in een Belgisch ziekenhuis met 60% toe.
In 2010 had 1.5% van de klassieke hospitalisaties in Belgische ziekenhuizen betrekking op patiënten uit het buitenland. Het aantal afgesloten zorgcontracten met zorgleveranciers of zorginstellingen om de verzorging van buitenlandse patiënten mogelijk te maken neemt toe. In 2010 hadden 29 Belgische ziekenhuizen in totaal 83 zorgcontracten voor geplande medische zorg bestemd voor buitenlandse patiënten, o.a. voor kankerbehandeling, of voor cardiovasculaire-, plastische- of orthopedische heelkunde,…
Buitenlandse patiënten die gebruik maken van geplande medische zorg in België komen vooral uit Nederland (58.4%), Frankrijk (19.8%), Groot Hertogdom Luxemburg (4.5%), Italië (2.9%) en Groot-Brittannië (2.8%). De arrondissementen Antwerpen, Gent, Brugge en Hasselt alsook Brussel Hoofdstad, tellen het grootste aantal geplande ziekenhuisverblijven van buitenlandse patiënten.
Deze patiënten kunnen ESBLE en/of CPE-positieve of andere MDRO’s (VRE, MRSA, Acinetobacter baumannii,…) importeren naar onze ziekenhuizen maar kunnen vervolgens natuurlijk ook de MDRO’s die in ons land circuleren, exporteren naar hun land van herkomst wat de globalisering en mondialisering van MDRO in de hand werkt.
3.3.5. De bewoners uit woonzorgcentra gelegen op de grens met onze buurlanden
Bewoners uit woonzorgcentra (cf. verpleeghuis en verzorgingstehuis in Nederland) vormen een andere potentiële bron van grensoverschrijdende overdracht van MDRO, o.a. via chronische zorginstellingen voor ouderen gelegen op de grens met onze buurlanden. In 2004, was een woonzorgcentrum gelegen op de Frans-Belgische grens duidelijk betrokken bij de import van ESBL-producerende Acinetobacter baumannii (VEB-1 type) vanuit Frankrijk (in epidemische situatie) in meerdere ziekenhuizen in België[8]. In deze, in het grensgebied gelegen WZC, heeft een belangrijke proportie bewoners (+/-60%) de Franse nationaliteit. Deze patiënten kunnen zowel in België als in Frankrijk in een acuut ziekenhuis opgenomen worden en kunnen daardoor bijdragen tot de overdracht van multiresistente bacteriën van één land naar een ander. In deze WZC zijn de met CPE (maar ook ESBLE) gekoloniseerde personen meestal asymptomatische dragers ter hoogte van de darm. Vaak gaat het hierbij over een zeer langdurig dragerschap (van 1 tot meerdere maanden). Via contacten bij activiteiten van het dagelijkse leven (hygiënische zorg, nauw zorgcontact, revalidatie,…) kunnen ze MDRO’s overdragen naar personen uit hun onmiddellijke omgeving of naar het verzorgingsteam. De klinische impact van dragerschap voor deze gezonde personen is waarschijnlijk eerder beperkt maar het risico voor reservoirvorming in WZC of in de gemeenschap is reëel.
[1] Advies van de Hoge Gezondheidsraad nr. 8791 (7 december 2011): Maatregelen te nemen naar aanleiding van de toename van carbapenemase producerende enterobacteriën (CPE) in België.
[2] Federale overheidsdienst Economie: Reizigersenquête, gegevens voor 2012.
[3] Federale Overheidsdienst Economie, Algemene Directie Statistiek en economische informatie: Statistisch overzicht van België: kerncijfers 2013.
[4] MUTAS: intermutualistisch projet voor dringende internationale medische hulpverlening in België.
[5] Observatorium patiëntenmobiliteit: Jaarrapport 2012 (RIZIV en FOD Volksgezondheid
[6] Geplande zorg voor buitenlandse patiënten: Impact op het Belgische gezondheidszorgsysteem: KCE reports 169A.
[7] Minimale klinische gegevens: 2004-2008.
[8] Epidemiologische enquête in verband met ESBL-producerende Acinetobacter baumannii (type VEB-1) in België.
IPH/EPI-reports: Nr. 2004 – 18. (http://www.nsih.be/download/acinetobacter/acinetobacter.pdf)
3.3.6. Het zorgpersoneel dat in het buitenland verbleven heeft als potentiële besmettingsbron voor patiënten
Ook al zijn er weinig cijfers beschikbaar over het belang van het zorgpersoneel als bron of reservoir voor besmetting van gehospitaliseerde patiënten of geïnstitutionaliseerde bewoners in chronische zorginstellingen, toch werden er occasioneel gevallen beschreven van CPE-overdracht naar patiënten via verzorgend personeel dat zelf in het buitenland verbleven had(14). Onder invloed van het vrije verkeer van diensten en personen binnen de Europese Unie observeren we eveneens een toename van het aantal buitenlandse zorgverstrekkers in ziekenhuizen en woonzorgcentra in ons land. Ook deze subpopulatie reist waarschijnlijk vaker naar het thuisland.
Screening van medisch- en paramedisch personeel bij sporadische of gegroepeerde CPE-gevallen is in eerste instantie niet aanbevolen, maar deze maatregel kan eventueel lokaal wel overwogen worden indien een epidemie ondanks de strikte toepassing van maatregelen ter preventie en controle van overdracht, niet onder controle kan gebracht worden.
Tabel 1: Cijfermateriaal met betrekking tot buitenlandse reizenmedische repatriëring, geplande medische zorg voor buitenlandse patiënten en immigratie in België
3.4. Het risico voor verspreiding van (reisgerelateerde-) CPE
3.4.1. België, een land met een grote bevolkingsdichtheid
Naast de verschillende, hierboven beschreven potentiële importbronnen van reisgerelateerde CPE heeft België ook een potentieel verhoogd risico voor verspreiding van CPE en andere MDRO’s omwille van de hoge bevolkingsdichtheid en het dichte netwerk van zorginstellingen die ons land kenmerken. België is een van de Europese landen met de hoogste bevolkingsdichtheid (367 inwoners per km2, Figuur 7). Ons land wordt hierin, enkel voorafgegaan door Malta (1327/km2) en Nederland (497/km2). Ter vergelijking, bij de laatste volkstelling bedroeg de bevolkingsdichtheid in India 382 inwoners/km2 (Delhi: > 11.000/km2).
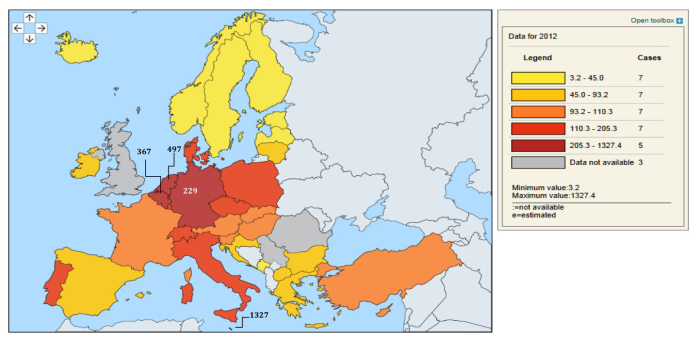
Figuur 7: Bevolkingsdichtheid in Europa (bron: Eurostat, population density, data 2012)
De bevolkingsdichtheid in ons land verschilt echter sterk per provincie en regio (Figuur 8): zo is de bevolkings-dichtheid in Vlaanderen tweemaal hoger dan in Wallonië. De hoogste bevolkingsdichtheid komt voor in het Brussels Hoofdstedelijk Gewest (7249 inwoners/km2) maar eveneens in de provincies Antwerpen (643), Vlaams-Brabant (523) en Oost-Vlaanderen (496).
De laagste bevolkingsdichtheid komt voor in de provincies Luxemburg (62/km2), Namen (133) en Luik (284).
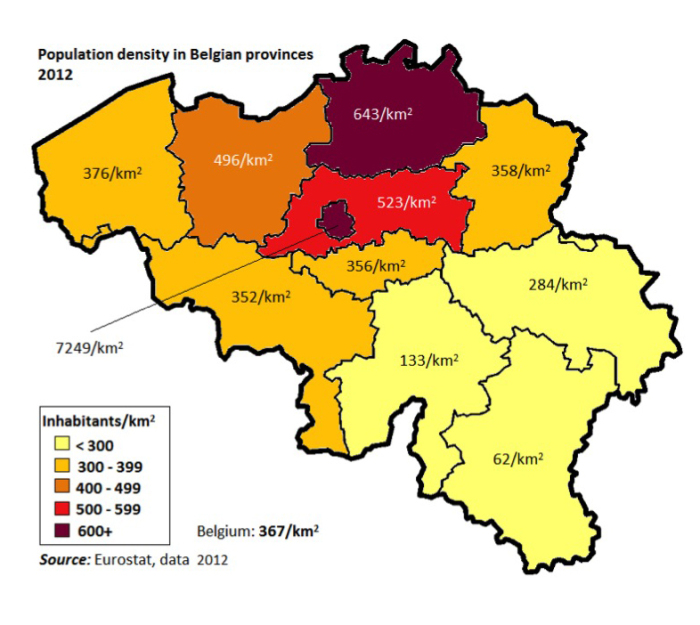
Figuur 8: Bevolkingsdichtheid per provincie in België (Bron: Eurostat, population density by region NUTS 2, data 2012)
Eerder onderzoek suggereerde al dat bevolkingsdichtheid (en overbevolking) een belangrijke beïnvloedende factor zou kunnen zijn voor de prevalentie van antibioticaresistentie in de bevolking(15)–(16). De bevolkingsdichtheid beïnvloedt de circulerende antibioticaresistente bacteriën in de gemeenschap: hoe hoger de populatiedensiteit, hoe groter de kans voor kruisoverdracht tussen mensen die er in nauw contact samen leven.
Sommige stedelijke gebieden (grootsteden) cumuleren de potentiële bronnen van CPE-import: hoge bevolkingsdichtheid, dicht netwerk van zorginstellingen, concentratie van universitaire ziekenhuizen, grotere proportie bewoners van vreemde afkomst, meer toerisme.
In 2012-2013, had 33% van al de in België gerapporteerde CPE-gevallen geen enkel contact gehad met gezondheidszorg (acuut ziekenhuis, WZC) in de 12 maanden voorafgaand aan de CPE-detectie. Ook als wordt de aanwezigheid van voorafgaande contacten met zorginstellingen waarschijnlijk sterk ondergerapporteerd (net zoals reisgerelateerde gevallen), toch laat dit vermoeden dat CPE mogelijks al ruimschoots verspreid is in de gemeenschap in België. Gerichte studies zijn daarom noodzakelijk om de omvang van deze reservoirs in de verschillende sectoren van de gezondheidszorg alsook in de verschillende bevolkingsgroepen en subgroepen in de gemeenschap te meten
4-Tot slot
Aan de hand van de actieve CPE-surveillance opgestart in België in 2012, krijgt men enig idee in verband met het voorkomen van aan het buitenland gerelateerde CPE-gevallen in België. Dit artikel toont de beperkingen van de surveillance (36% ontbrekende gegevens) en illustreert eveneens andere potentiële bronnen van CPE-import, al dan niet gerelateerd aan gezondheidszorgcontacten in het buitenland.
Omwille van de mondialisering van de problematiek van multiresistente bacteriën en van CPE in het bijzonder is het aangewezen om patiënten die gezondheidszorgen toegediend kregen in het buitenland te beschouwen als patiënten met een verhoogd risico, dit ongeacht het land hoewel het risico en het type CPE tussen de verschillende geografische zones kunnen verschillen.
Verder dient men alert te blijven in situaties waarbij de hierboven beschreven bronnen van CPE-import aanwezig kunnen zijn.
Momenteel is een werkgroep, bestaande uit door de Hoge Gezondheidsraad gemandateerde experten, bezig met het bijwerken van de richtlijnen betreffende de diagnose, de preventie en de beheersing van de overdracht van CPE in acute- en in chronische zorginstellingen in België. Een screeningsbeleid gebaseerd op evidence zal een belangrijk onderdeel vormen van deze richtlijnen.
Op 30 september 2013, ondertekenden de Federale- en Gemeenschapsministers bevoegd voor Volksgezondheid het protocolakkoord (Belgisch Staatsblad van 21 november 2013) met betrekking tot het Nationaal MDRO-plan. Dit plan tekent de grote krijtlijnen voor een gecoördineerde aanpak van antibioticaresistentie in ons land waarbij alle dynamische krachten (experten, overheden, gezondheidswerkers, patiënten en betrokken verenigingen) gebundeld worden om de te ondernemen acties te ondersteunen, te bestendigen en verder te zetten. Teneinde dit nationaal MDRO-plan te verwezenlijken wordt een Technisch Comité-MDRO (TC-MDRO) en een Nationale Commissie ter bestrijding van MDRO’s (NCB-MDRO) opgericht in ons land.
Het TC-MDRO heeft als opdracht: de risicobeoordeling met betrekking tot zowel het voorkomen van nieuwe MDRO’s als de evolutie van al gekende MDRO’s, de analyse van de resultaten van de bestaande surveillances en epidemiologische/microbiologische studies m.b.t. MDRO, het optimaliseren van deze surveillances en waar nodig het implementeren van nieuwe surveillances en studies. De NCB-MDRO is gelast met de bekrachtiging en de implementatie van de aanbevelingen van het TC-MDRO, de coördinatie en opvolging van de initiatieven van hun leden in de strijd tegen MDRO en de communicatie m.b.t. de aanpak van MDRO in België.
Het Nationaal MDRO-plan richt tevens een ‘outbreak support team’ (OST) op dat, waar nodig, ondersteuning kan bieden aan ziekenhuizen in een epidemische situatie waarbij MDRO’s betrokken zijn. Het OST is samengesteld uit het team voor ziekenhuishygiëne en de directie van het betrokken ziekenhuis, de uitbraakequipes van de gefedereerde entiteiten, het WIV-ISP, de afgevaardigde van het relevante NRC en indien nodig een groep van relevante externe experten.
Wij hopen dat het geheel aan voorgestelde acties zal toelaten om de MDRO-problematiek in te dijken of minstens zijn impact op de zorginstellingen in ons land te beperken.
Referenties
(1) Ruppe E, Armand-Lefevre L, Estellat C, El-Mniai A, Boussadia Y, Consigny PH, et al. Acquisition of carbapenemase-producing Enterobacteriaceae by healthy travellers to India, France, February 2012 to March 2013. Euro Surveill 2014;19(14).
(2) Murray BE, Mathewson JJ, DuPont HL, Ericsson CD, Reves RR. Emergence of resistant fecal Escherichia coli in travelers not taking prophylactic antimicrobial agents. Antimicrob Agents Chemother 1990 Apr;34(4):515-8.
(3) Laupland KB, Church DL, Vidakovich J, Mucenski M, Pitout JD. Community-onset extended-spectrum beta-lactamase (ESBL) producing Escherichia coli: importance of international travel. J Infect 2008 Dec;57(6):441-8.
(4) Tangden T, Cars O, Melhus A, Lowdin E. Foreign travel is a major risk factor for colonization with Escherichia coli producing CTX-M-type extended-spectrum beta-lactamases: a prospective study with Swedish volunteers. Antimicrob Agents Chemother 2010 Sep;54(9):3564-8.
(5) Ostholm-Balkhed A, Tarnberg M, Nilsson M, Nilsson LE, Hanberger H, Hallgren A. Travel-associated faecal colonization with ESBL-producing Enterobacteriaceae: incidence and risk factors. J Antimicrob Chemother 2013 Sep;68(9):2144-53.
(6) Paltansing S, Vlot JA, Kraakman ME, Mesman R, Bruijning ML, Bernards AT, et al. Extended-spectrum beta-lactamase-producing enterobacteriaceae among travelers from the Netherlands. Emerg Infect Dis 2013 Aug;19(8):1206-13.
(7) Tham J, Odenholt I, Walder M, Brolund A, Ahl J, Melander E. Extended-spectrum beta-lactamase-producing Escherichia coli in patients with travellers’ diarrhoea. Scand J Infect Dis 2010 Apr;42(4):275-80.
(8) Arcilla MS, van Hattem JM, Bootsma MC, van Genderen PJ, Goorhuis A, Schultsz C, et al. The Carriage Of Multiresistant Bacteria After Travel (COMBAT) prospective cohort study: methodology and design. BMC Public Health 2014;14:410.
(9) Freeman JT, McBride SJ, Heffernan H, Bathgate T, Pope C, Ellis-Pegler RB. Community-onset genitourinary tract infection due to CTX-M-15-Producing Escherichia coli among travelers to the Indian subcontinent in New Zealand. Clin Infect Dis 2008 Sep 1;47(5):689-92.
(10) Ahmed-Bentley J, Chandran AU, Joffe AM, French D, Peirano G, Pitout JD. Gram-negative bacteria that produce carbapenemases causing death attributed to recent foreign hospitalization. Antimicrob Agents Chemother 2013 Jul;57(7):3085-91.
(11) van der Bij AK, Pitout JD. The role of international travel in the worldwide spread of multiresistant Enterobacteriaceae. J Antimicrob Chemother 2012 Sep;67(9):2090-100.
(12) MacPherson DW, Gushulak BD, Baine WB, Bala S, Gubbins PO, Holtom P, et al. Population mobility, globalization, and antimicrobial drug resistance. Emerg Infect Dis 2009 Nov;15(11):1727-32.
(13) Baraniak A, Grabowska A, Izdebski R, Fiett J, Herda M, Bojarska K, et al. Molecular characteristics of KPC-producing Enterobacteriaceae at the early stage of their dissemination in Poland, 2008-2009. Antimicrob Agents Chemother 2011 Dec;55(12):5493-9.
(14) Perez F, Van DD. Carbapenem-resistant Enterobacteriaceae: a menace to our most vulnerable patients. Cleve Clin J Med 2013 Apr;80(4):225-33.
(15) Bruinsma N, Hutchinson JM, van den Bogaard AE, Giamarellou H, Degener J, Stobberingh EE. Influence of population density on antibiotic resistance. J Antimicrob Chemother 2003 Feb;51(2):385-90.
(16) MacDougall C, Powell JP, Johnson CK, Edmond MB, Polk RE. Hospital and community fluoroquinolone use and resistance in Staphylococcus aureus and Escherichia coli in 17 US hospitals. Clin Infect Dis 2005 Aug 15;41(4):435-40.
Nieuwigheden
Wetenschappelijke agenda
- oktober 2024
-
van 16/10 tot 20/10 || in Los Angeles
SHEA ID week. A joint meeting of IDSA, SHEA, HIVMA, PIDS and SIDP
- november 2024
-
van 20/11 tot 22/11 || in Liverpool
Healthcare infection society
- april 2025
-
van 11/04 tot 15/04 || in Wenen
Congrès de l’ European Society of Clinical Microbiology and Infectious Diseases (ESCMID)
- juni 2025
-
van 4/06 tot 6/06 || in Marseille
35ème Congrès National de la Société Française d’Hygiène Hospitalière (SF2H)
-
van 17/06 tot 18/06 || in Londen
HIS congres (Healthcare Infection Society)