Colistineresistentie bij gram-negatieve bacteriën
Samenvatting
De strijd tegen multiresistente bacteriën (MDRO) is een belangrijke uitdaging voor de volksgezondheid. De recente opkomst van multiresistente en zelfs panresistente stammen wordt geïllustreerd door de zo goed als wereldwijde verspreiding van carbapenemaseproducerende enterobacteriën (CPE), die enkel nog gevoelig zijn voor colistine. Colistine wordt vaak gebruikt in de dierengeneeskunde voor de behandeling van gram-negatieve infecties bij fokdieren. In de humane geneeskunde is dit antibioticum daarentegen lange tijd amper gebruikt, omwille van de renale toxiciteit en door de opkomst van actievere en minder toxische antibiotica. Intussen wordt colistine opnieuw voorgeschreven in de humane geneeskunde, vaak als laatste redmiddel bij een ernstige infectie veroorzaakt door multiresistente bacteriën zoals CPE. Colistine-resistentie is snel weer opgedoken na het herinvoeren in het ziekenhuis. Vooral in landen waar de prevalentie van deze bacteriën hoog is, is ze aan een opmars bezig. Meestal is deze resistentie het gevolg van chromosoommutaties in verschillende genen. Dit leidt tot wijzigingen in de lipopolysaccharidestructuur (LPS) waardoor colistine zich niet meer op de bacteriewand kan vasthechten.
Onlangs werd bij de enterobacteriën melding gemaakt van genen met een plasmide-gebonden resistentie tegen colistine (mcr-1 en mcr-2), vooral bij Escherichia coli. Na de eerste observaties in China, doken al snel gelijkaardige verslagen op waarin op alle continenten, waaronder Europa (ook België), melding werd gemaakt van de verspreiding van colistine-resistente stammen. Toch zijn de meeste mcr-1/mcr-2-isolaten gemeld bij dieren uit de productieketen of bij voedingsproducten van dierlijke oorsprong en veel minder vaak bij de mens. Ondanks dat plasmide-gebonden resistentie tegen colistine in de humane geneeskunde zelden voorkomt, blijft waakzaamheid geboden en dient de evolutie van de prevalentie en van de incidentie van deze resistentie in verschillende ecosystemen (bijv.: in acute ziekenhuizen, in instellingen voor chronische zorgen en in de gemeenschap) en op een bredere steekproef (niet enkel op de isolaten die meest resistent zijn tegen antibiotica zoals ESBL of CPE) te worden opgevolgd. De opkomst en de verspreiding van plasmide-gebonden resistentie tegen colistine is onrustwekkend, omdat door de uitbreiding ervan één van de laatste efficiënte therapeutische opties voor multiresistente of panresistente bacteriën in het gedrang zou kunnen komen. Deze bedreiging past trouwens binnen een globaal kader waarbij de beschikbare middelen en de vooruitzichten op de ontwikkeling van nieuwe antibiotica die op die organismen inwerken, redelijk beperkt blijven. De optimimalisering van het klinisch gebruik van colistine (keuze/indicatie, toedieningsmodaliteiten, therapeutische opvolging) is dan ook steeds belangrijker en dus een absolute prioriteit.
Structuur en werking
Het spectrum van de antibacteriële werking van polymyxines, de antibioticaklasse waartoe colistine behoort, beperkt zich tot gram-negatieve bacteriën (waaronder enterobacteriën, Pseudomonas aeruginosa en Acinetobacter spp.). Slechts enkele soorten zijn natuurlijk resistent tegen colistine (de meest bekende zijn Serratia spp., Proteus spp., Morganella spp., Providencia spp. en Burkholderia cepacia en sinds kort ook, Hafnia alvei, Jayol JAC 2017). Ze zijn inactief tegen gram-positieve en tegen de meeste anaërobe bacteriën.
Polymyxines zijn antibiotica die natuurlijk worden aangemaakt door verschillende soorten Paenibacillus polymyxa, die in 1947 in Japan zijn ontdekt. Vijf chemische verbindingen staan beschreven maar slechts twee daarvan worden voor therapeutische doeleinden gebruikt: polymyxine B en polymyxine E (of colistine). Deze molecules met een hoog moleculair gewicht (+/- 1200 Da) zijn kationische polypeptiden die bestaan uit een cyclus van 7 aminozuren en een tripeptide laterale keten, waarop op covalente wijze een vetzuur is gebonden. Deze bijzondere chemische structuur verleent hen zowel hydrofiele (aminogroep van positief geladen aminozuren van de cyclus) als lipofiele (negatief geladen vetzuur met lange keten) eigenschappen.
Polymyxines werken in op bacteriële lipopolysaccharide (LPS), onderdeel van het buitenmembraan van de gram-negatieve bacillen. Dankzij hun polykationische structuur hechten deze moleculen zich aan de LPS (in plaats van de ionen Ca++ en Mg++), wat tot een verstoring van het buitenmembraan leidt en vervolgens tot een verhoging van de doorlaatbaarheid van het cytoplasmische membraan. Deze belangrijke wijzigingen leiden tot het snel breken van het membraan en tot de dood van de bacterie. Polymyxines zijn snel bacteriedodende antibiotica, waarbij de werking ervan concentratie-afhankelijk is (net zoals bij aminoglycosiden). De belangrijkste parameters die hun PK/PD werking bepalen, zijn de maximale serumconcentratie en de oppervlakte onder de tijdkromme t.o.v. de minimale inhiberende concentratie (Cmax/MIC en AUC/MIC).
Klinisch gebruik
Colistine kan in twee farmaceutische vormen worden gebruikt. Colistinesulfaat kan via orale weg en voor topicaal gebruik worden toegediend. Als colistimethaatnatrium kan het enkel via parenterale weg worden gebruikt. Colistimethaatnatrium is trouwens een inactieve prodrug van colistine, zonder enige intrinsieke antibacteriële werking. Colistinesulfaat en colistimethaatnatrium worden haast niet door het maag-darmkanaal geabsorbeerd. Daarom wordt colistimethaatnatrium voor de behandeling van diepe infecties via parenterale weg gebruikt. Colistine werd sinds de jaren 1960 voor therapeutische toepassingen bij de mens gebruikt voor de behandeling van infecties met gram-negatieve bacteriën. Vanaf de jaren 1970 daalde het gebruik ervan snel, enerzijds omwille van de gerapporteerde neveneffecten (nefrotoxiciteit, neurotoxiciteit) en anderzijds door de opkomst van nieuwe meer actieve en minder schadelijke antibiotica (aminoglycosiden, chinolonen, β-lactams). Twintig jaar lang werd colistine uitsluitend gebruikt voor uitwendige behandelingen (oftalmologie, dermatologie) of voor de behandeling van zeer specifieke infecties (bijv.: systemisch gebruik of via verneveling voor de behandeling van longinfecties bij mucoviscidosepatiënten). De nieuwe uitbraak van multiresistente en panresistente gram-negatieve bacteriën (vooral de CPE) heeft ervoor gezorgd dat colistine sinds een tiental jaar opnieuw in de humane geneeskunde wordt gebruikt. Het gebruik ervan in de dierengeneeskunde (behandeling, profylaxie) bleef daarentegen intensief en het overdreven gebruik van colistine als groeistimulator in de voedingsmiddelenindustrie is niet alleen een grote economische uitdaging, maar tegelijk ook een groot probleem voor de volksgezondheid, door het risico op snelle resistentie in de verschillende ecosystemen (dierlijk en menselijk).
Resistentiemechanismen
Resistentie tegen colistine heeft te maken met de gewijzigde samenstelling van de LPS van de gram-negatieve bacteriën. Deze wijzigingen zorgen alle voor een daling van de negatieve lading van de LPS, met name via toevoeging van positief geladen residuen, wat dan weer leidt tot een daling van de affiniteit van (positief geladen) colistine voor haar doel. Andere resistentiemechanismen die minder aan bod komen zijn de synthese van een externe capsule (die colistine via trapping absorbeert en op die manier hechting aan de LPS belet) of de overexpressie van bepaalde effluxpompen (die leidt tot het uitstoten van het antibioticum uit de bacterie naar de extracellulaire omgeving).
De afwijkingen aan de LPS hebben te maken met wijzigingen van lipide A, die meestal de optelling van twee afzonderlijke types kationgroepen bevat (fosfoethanolamines [pEtN] of 4-amino-4-desoxy-L-arabinose [L-Ara4N]).
Bij de enterobacteriën zijn deze wijzigingen van de LPS nauwkeurig geregeld door twee afzonderlijke systemen met twee zogenaamde componenten PhoP/PhoQ en PmrA/PmrB. Het systeem PhoP/PhoQ wordt zelf geregeld door het transmembraaneiwit MgrB. Meestal correleert resistentie tegen colistine met afwijkingen van de chromosomale genen (mutaties, deleties of inserties) in één van de systemen met twee componenten en/of van het gen mgrB. Bij de enterobacteriën komt het meest voorkomende resistentiemechanisme overeen met een inactivering van het gen mgrB, dat een negatief regulerende rol op het PhoP/PhoQ systeem heeft. De minimaal inhiberende concentratie (MIC) van colistine bij de stammen met een afwijking van het gen mgrB bedraagt meestal tussen 4 en 64 mg/L. Van de ontwikkeling van een plasmide-gebonden resistentie tegen colistine die van één soort op een andere overdraagbaar is, werd voor het eerst eind 2015 melding gemaakt onder de benaming MCR-1. Het eiwit MCR-1 maakt deel uit van de familie van de fosfoethanolamine transferase, waarvan de expressie bij E. coli en bij K. pneumoniae leidt tot de optelling van pEtN op het vet A. Door de wijzigingen van de LPS door toevoeging van pEtN is het niveau van resistentie tegen polymyxines geringer dan bij toevoeging van L-Ara4N. Dit verklaart waarom de stammen met het resistentiemeccanisme MCR-1 een geringer resistentieniveau hebben, aangezien de MIC colistine normaal tussen de 4 en 8 mg/L ligt.
Sinds de initiële beschrijving ervan in China op basis van stammen van fokdieren (vooral varkens en gevogelte), levensmiddelen (vlees) en stammen van menselijke herkomst, wordt op alle continenten melding gemaakt van de aanwezigheid van positieve stammen van enterobacteriën mcr-1 (vooral E. coli en in mindere mate Salmonella spp. en in een aantal heel zeldzame gevallen bij K. pneumoniae en Enterobacter spp.). Sindsdien werden bovendien twee andere varianten die verwant zijn met het gen mcr-1 (mcr-1.2 en mcr-2) beschreven. De genen mcr-1 en aanverwanten zijn aanwezig op tal van plasmiden, wat wijst op een brede verspreiding van deze resistentie in de veterinaire wereld, vooral dan bij fokdieren. Ook al wordt dat resistentiemechanisme als «nieuw» beschouwd, toch maakten verschillende retrospectieve studies al melding van de aanwezigheid van MCR-1-producerende stammen sinds de jaren 1980 (isolatie bij gevogelte in China) en in Europa sinds begin van de jaren 2000 (isolatie bij kweekkalveren in Frankrijk vanaf 2005), wat erop wijst dat het mechanisme van resistentie tegen colistine niet zo recent is. Men gaat ervan uit dat de opvallende ontwikkeling van dit resistentiemechanisme, dat sinds 2008-2010 in een veterinaire omgeving werd vastgesteld, mogelijk het gevolg was van het intensieve gebruik van polymyxines bij dieren (vooral bij het fokken van varkens en runderen). Bij de mens daarentegen blijft de prevalentie van positieve mcr-1-stammen nog altijd zeer gering (<0.1% bij E. coli). Toch bestaan er nog altijd weinig studies en bovendien zijn ze vaak beperkt in omvang en gericht op zeer specifieke bevolkingsgroepen (screening op dragerschap van MDR-bacteriën op basis van rectale uitstrijkjes bij gehospitaliseerde patiënten of bij bewoners in zorginstellingen voor langdurig verblijf).
Epidemiologie
De prevalentie van de resistentie tegen colistine blijft momenteel in tal van landen laag. In Europa bleek uit gegevens van het surveillanceprogramma EARS-Net van het ECDC dat het gemiddelde resistentiecijfer in 2015 zo’n 1% bedroeg voor E. coli en 8-9% voor K. pneumoniae. Dit antibioticum werd evenwel maar in een heel beperkt aantal landen systematisch getest (6 landen op 30). In ditzelfde verslag bedroeg het gemiddelde resistentiecijfer bij P. aeruginosa en bij Acinetobacter spp, respectievelijk 1% en 4%. Globaal genomen wordt al naargelang het land, een heel uiteenlopende situatie vastgesteld, waarbij de prevalentie van de resistentie tegen colistine nauw lijkt samen te hangen met de resistentie tegen carbapenems. Zo blijft de prevalentie van resistentie tegen colistine momenteel laag (< 5 % ook bij de natuurlijk resistente soorten) in de landen waar de verspreiding van de CPE’s nog laag is (bv. Frankrijk, België, Duitsland, Zweden, Finland, Denemarken en Noorwegen). De situatie is daarentegen veel alarmerender (20 à 30 % van de resistentie tegen colistine, met name bij K. pneumoniae) voor een aantal landen die als endemisch voor de CPE’s worden beschouwd (bv. Griekenland of Italië). In 2015 was 95% van de gerapporteerde stammen die resistent waren tegen colistine in het EARS-Net surveillanceprogramma afkomstig uit Griekenland en Italië. Opvallend was dat de aanzienlijke stijging van het gebruik van colistine (met een factor x6 in Griekenland tussen 2009 en 2013) voor de behandeling van infecties met multiresistente gram-negatieve bacillen, de snelle ontwikkeling van de resistentie in de hand heeft gewerkt. Naast het effect van de selectiedruk die te maken heeft met het toegenomen gebruik van colistine in de klinische praktijk, kan de verspreiding van epidemische stammen bijdragen tot de verhoging van de resistentie. Dit is het geval in Italië, waar tussen 2012 en 2016 verschillende ziekenhuisepidemieën veroorzaakt door MDR-stammen, die resistent waren tegen colistine (vooral CPE’s van het type KPC), zijn gedocumenteerd.
In België zijn er geen gegevens beschikbaar over de prevalentie van de resistentie tegen colistine in de humane geneeskunde omdat, slechts weinig laboratoria dit antibioticum testen (en over het algemeen dan nog tweedelijns, vooral op stammen met een multiresistent karakter en enkel in een ziekenhuisomgeving). In het kader van zijn opdrachten als referentiecentrum heeft ons laboratorium de in vitro colistinegevoeligheid gemeten op basis van een steekproef van 800 multiresistente enterobacteriënstammen, waarvan de meeste een geringere gevoeligheid of een resistentie tegen carbapenems vertoonden. Deze op basis van klinische stalen of van screeningsuitstrijkjes in meer dan 90 Belgische laboratoria (van ziekenhuizen en private) geïsoleerde stammen, werden ons eerstelijns bezorgd voor bevestiging van CPE. Een resistentie geassocieerd met colistine kon worden aangetoond voor 1% van de E. coli-stammen en voor 12% van de geteste K. pneumoniae. Opvallend was dat in de loop der tijd een significante stijging van de resistentie werd vastgesteld (14% in 2015 vs. 8% in 2015), vooral bij de carbapenemaseproducerende K. pneumoniae type KPC (29/87 [33%] in 2015 vs. 10/72 [14%] in 2014; p <0.001), maar niet voor die die andere types carbapenemasen produceren. Deze laatste waarneming wijst sterk op een verhoging van de resistentie tegen colistine, die te maken heeft met de regionale en interregionale epidemische verspreiding van in België aangetroffen KPC-3 carbapenemaseproducerende stammen, waarvan het klonale karakter goed bekend is (epidemische kloon).
Op een totaal van 129 gram-negatieve bacteriestammen, die resistent zijn tegen colistine en die in 2014 en 2015 zijn getest door PCR voor het opsporen van plasmide-gebonden resistentie tegen colistine van het type MCR, waren slechts 2 stammen E. coli (beide carbapenemaseproducerend OXA-48) ook positief door PCR voor mcr-1. In 2016 en in 2017 heeft het referentielaboratorium bevestigd dat het gen mcr-1 aanwezig was in 7 E. coli-stammen, die resistent zijn tegen colistine (afkomstig van 5 laboratoria). Typisch is dat ze zeer gevoelig zijn voor de meeste antibiotica (met uitzondering van ampicilline, cotrimoxazole en voor een aantal daarvan, flurochinolonen). Dit wijst erop dat het vermoedelijk aangewezen is om in het kader van incidentie- of prevalentiestudies het onderzoek naar de plasmide-gebonden resistentie tegen colistine type MCR niet enkel te beperken tot multiresistente stammen (type ESBL of CPE). Het is ook interessant te onderstrepen dat plasmide-gebonden resistentie tegen colistine tot op heden nog niet is beschreven bij P. aeruginosa noch bij Acinetobacter spp.
Gelet op het uitblijven van ziekenhuisepidemieën geassocieerd met de aanwezigheid van MCR-1-producerende enterobacteriën-stammen, de gebrekkige kennis over de risicofactoren op vlak van dragerschap, het zeer uitzonderlijk voorkomen van ziekenhuisepidemieën geassocieerd met de soort E. coli en het hoge aantal in de gemeenschap-verworven MCR-positieve stammen die multi-gevoelig zijn voor antibiotica (niet geassocieerd met ziekenhuisinfecties), lijkt het ons momenteel niet aangewezen een specifieke screening uit te voeren voor het onderzoek naar het mechanisme van resistentie tegen colistine type MCR bij gehospitaliseerde patiënten (behalve in de studiecontext van de evaluatie van de risicofactoren). In die gevallen kan het verstandig zijn veeartsen, fokkers en alle professionals die met fokdieren in aanraking komen als een potentiële risicogroep te beschouwen, bovenop de andere reeds vooraf bepaalde risicofactoren voor het onderzoek naar asymptomatisch dragerschap van ESBL of CPE (hospitalisatie in het buitenland of rechtstreekse repatriëring om medische redenen…).
Aanbevolen methodes voor het opsporen van resistentie tegen colistine
Belangrijk is de keuze van de methodologie die in het laboratorium wordt gebruikt om de in vitro gevoeligheid van colistine te testen. Het is algemeen bekend dat nationale/regionale verschillen in de waargenomen resistentiecijfers deels kunnen worden verklaard door de verschillende methodologieën die in de verschillende studies worden gebruikt. Momenteel luidt de aanbeveling de colistinegevoeligheid niet langer te evalueren met diffusiemethodes in een vast milieu (schijfjes of teststrips per verspreidingsgradient type Etest of analoog). Door hun hoge moleculaire gewicht verspreiden polymyxines zich slecht op agarplaten, waardoor de colistinegevoeligheid niet goed kan worden ingeschat. De door wetenschappelijke verenigingen (zowel EUCAST als CLSI) aanbevolen referentiemethode voor de evaluatie van de gevoeligheid van bacteriën voor polymyxines is de dilutiemethode in een vloeistof (macro- of microdilutie) (http://www.eucast.org/fileadmin/src/media/PDFs/EUCAST_files/General_documents/Recommendations_for_MIC_determination_of_colistin_March_2016.pdf).
In 2017 werden de klinische breakpointswaarden geharmoniseerd voor de verschillende groepen bacteriën (Enterobacteriën, Pseudomonas aeruginosa, Acinetobacter spp.), waardoor ze nu identiek zijn voor de twee belangrijkste referentiekaders (EUCAST en CLSI) (cfr. tabel 1). Het CLSI bepaalt evenwel nog altijd geen klinische breakpointwaarden voor colistine bij de enterobacteriën. Het stelt enkel specifieke epidemiologische (ECV) drempelwaarden (cut-off) voor en dan nog maar alleen voor bepaalde soorten (cfr. tabel 1). De in diameter uitgedrukte drempelwaarden (S en R) zijn bovendien ook geschrapt, zowel voor het CLSI als voor EUCAST.
EUCAST tenslotte beveelt aan om als kwaliteitscontrole voor het testen van colistine, naast de inclusie van twee gevoelige stammen (E. coli ATCC 25922 en P. aeruginosa ATCC 27853) ook die van een colistineresistente (E. coli NCTC13846) en MCR-1-producerende stam te gebruiken.
Tabel 1. Kritische waarden voor colistine volgens de aanbevelingen van EUCAST en het CLSI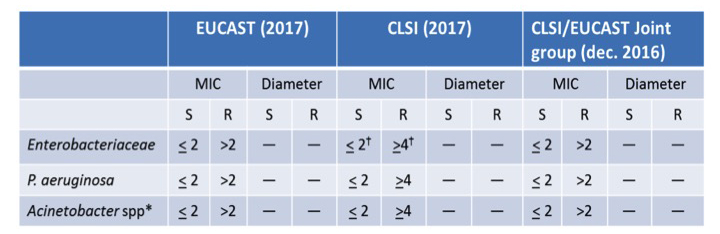
†Geen klinische breekpunten voor het CLSI maar enkel epidemiologische cut off waarden (ECoff); zijn heel specifiek van toepassing op bepaalde soorten (E. aerogenes, E. cloacae, E. coli, K. pneumoniae).
Aangezien de bouillon-microdilutie referentiemethode (Standaard ISO 20776-1) niet routinematig bruikbaar is in klinische laboratoria, zijn verschillende alternatieve methodes geëvalueerd om de colistinegevoeligheid te testen.
De agar-gel-diffusiemethodes (schijfjes, teststrips per verspreidingsgradient) leveren vaak foutieve resultaten op, waarbij de resistente stammen tot in 20 à 30% van de gevallen niet worden opgespoord (vals positieven en zeer ernstige fouten) in vergelijking met de MIC-bepaling via de microdilutiemethode. «Gebruiksklare» microdilutiesystemen maken gebruik van ofwel vooraf bepaalde concentratiegamma’s van verschillende gevriesdroogde antibiotica zoals colistine (96-wells-platen [Sensititre, Thermofisher Scientific, UK]), ofwel strips met concentraties colistine alleen (MICRONAUT MIC-Strip [Merlin Diagnostika Germany] of het UMIC-systeem [Biocentric, France]) en zijn momenteel in de handel beschikbaar.
In een recente studie (Hindler JA, Humphries RM., J Clin Microbiol 2013) leverde het Sensititre®-systeem uitstekende resultaten op voor colistine, waarbij de resultaten gecorreleerd waren met de referentiemethode door microdilutie in 95% van de gevallen (categorieconcordantie van de resultaten S/I/R), zonder enig vals positief resultaat voor de resistente stammen (afwezigheid van zeer ernstige fouten).
De in de handel verkrijgbare systemen in de vorm van een unieke strip (zoals MICRONAUT MIC-Strip, of UMIC) bevatten elk een breed concentratiegamma van enkel colistine (van 0.06 tot 64 µg/ml) en blijken dan ook zeer praktisch om de resultaten te bevestigen voor colistine op basis van de routinematig gebruikte methode. Net als voor de Sensititre®-methode worden de MIC-resultaten verkregen na incubatie gedurende 18-24 uur aan 35°C en zijn ze gecorreleerd met die van de referentiemethode via microdilutie. Uit een recente evaluatie uitgevoerd in ons laboratorium op een totaal van meer dan 100 stammen enterobacteriën (waarvan meer dan de helft resistent waren tegen colistine) bleek voor beide tests een uitstekende correlatie t.o.v. de met de Sensititre® verkregen resultaten (gebruikt als referentiemethode), waarbij een categorieconcordantie werd vastgesteld in 95-100% van de gevallen en bijna geen vals positieve resultaten voor de stammen enterobacteriën. Opvallend is dat er bij die verschillende commerciële methodes zelden ongeldige en niet-interpreteerbare (aanwezigheid van «skip wells», of paradoxale groei van de stam in geïsoleerde putten van hogere concentraties met groei-inhibitie met een geringere concentratie) resultaten worden vastgesteld (in 1-3% van de gevallen). In die gevallen moet de test worden overgedaan.
De geautomatiseerde systemen (VITEK2, Phoenix, Microscan) zijn niet FDA gevalideerd om colistine te testen en in de literatuur zijn slechts weinig gegevens beschikbaar wat hun prestaties voor dit antibioticum betreft. Een reeds oudere studie maakt melding van een geringere gevoeligheid voor het opsporen van de colistineresistentie met het VITEK2-systeem (Tan TY et al., Clin Microbiol Infect 2007). Ook een meer recente studie heeft het over een vals positief resultaat van zo’n 15% voor het opsporen van de colistineresistentie met het Phoenix-systeem (Poirel et al., Clin Microbiol Rev. 2017). Opvallend is dat de stammen met een plasmide-gebonden resistentie tegen colistine van het type MCR-1 in deze studie nochtans goed gedetecteerd werden.
Zoals de zaken er nu voor staan en in afwachting van de resultaten van andere studies, lijkt het wenselijk om bij het gebruik van geautomatiseerde systemen het resultaat van de colistinegevoeligheid te bevestigen door een andere methode (in microdilutie met behulp van een commerciële test), vooral in situaties waarin een therapeutische indicatie van colistine wordt beoogd.
Met de nieuwe «Rapid Polymyxin NP™»-test, die op de markt is gebracht door het bedrijf ELITech Group, kunnen de colistineresistente stammen ook in 2 à 4 uur worden opgespoord, ongeacht het soort geteste enterobacterie of het moleculaire mechanisme dat aan de oorsprong van die resistentie ligt. Het principe van deze test is gebaseerd op het opsporen van de metabolisering van glucose gerelateerd aan de bacteriegroei in aanwezigheid van een bepaalde concentratie (2 µg/ml) colistine. Deze test kan dus enkel worden toegepast op de enterobacteriën (maar niet voor de niet-fermenterenden). De bacteriegroei wordt aangetoond door een pH-indicator die van kleur verandert (geel/oranje). Uit voorafgaande studies blijkt een goede correlatie van de resultaten met de referentiemethode (gevoeligheid >95%; specificiteit: 99%). Deze test kan makkelijk worden toegepast in een klinisch laboratorium en moet dus op basis van een standaard antibiogram in principe snel (2-4 uur in plaats van 18-24 uur voor de andere microbiologische methodes) de gevoeligheid of resistentie tegen colistine kunnen bevestigen bij enterobacteriën.
De moleculaire methodes zijn niet aanbevolen om de resistentie tegen colistine op te sporen, gelet op de vele resistentiemechanismen, het zeer variabele expressieniveau van de chromosomale genen die coderen voor de eiwitten betrokken in de synthese van de LPS en de moeilijkheid om het frequent in de genen vastgesteld genetisch polymorfisme (eenmalige mutaties) met resistentie te correleren. Toch is het mogelijk om met moleculaire amplificatietesten genen, die coderen voor de plasmide-gebonden resistentie type MCR (mcr-1/mcr-2), kwalitatief op te sporen. Verschillende tests zijn momenteel in de handel verkrijgbaar en maken een snelle opsporing van de MCR-resistentie mogelijk, rechtstreeks op klinische stalen of ter bevestiging op een bacteriekweek. Ons laboratorium kan via de microdilutiemethode de resistentie tegen colistine en de MIC-waarde bevestigen. Aan de hand van een moleculaire test op basis van de LAMP- technologie (bijv.: eazyplex® SuperBug mcr-1, Amplex, Germany) kunnen we ook de plasmide-gebonden resistentie opsporen. Deze tests worden dagelijks uitgevoerd in het kader van de routinematige activiteit van ons Nationaal Referentie Centrum (NRC).
Performantie van de laboratoria voor microbiologie in België voor het opsporen van resistentie tegen colistine
In het kader van een externe kwaliteitscontrole in 2017 (EEQ2017/2) heeft het Wetenschappelijk Instituut Volksgezondheid alle Belgische laboratoria een colistineresistent isolaat van Klebsiella pneumoniae (M/1450) toegestuurd. Behalve de resistentie tegen colistine (MIC=16 µg/ml) maakte deze stam ook een carbapenemase type KPC-3 (Klebsiella pneumoniae Carbapenemase, Ambler klasse A) aan en was die multiresistent. In dit geval was de resistentie tegen colistine niet van het type MCR (negatieve stam voor mcr-1/mcr-2), maar had die te maken met de aanwezigheid van een nonsense mutatie in het chromosomale gen mgrB (negatieve regulator van het systeem met twee componenten PhoPQ), die leidt tot de synthese van een afgeknot eiwit (Y41 codon stop).
Ook al had >95% van de 105 laboratoria de resistentie tegen colistine in deze stam correct opgespoord, toch werd vastgesteld dat zo’n 30% van de laboratoria (o.a. heel wat private laboratoria) geen colistinegevoeligheid testte. De meeste laboratoria gebruikten als enige techniek hun routinematige methode om de colistinegevoeligheid te bepalen, zonder dit achteraf door een andere test te bevestigen. Bovendien had een derde van de laboratoria geantwoord als antibiogramtechniek een agar-gel-diffusiemethode (vooral E-test of schijfjes) te gebruiken, dewelke momenteel niet meer wordt aanbevolen om colistinetesten uit te voeren. Slechts 8 laboratoria tenslotte lieten weten een microdilutiemethode voor colistine te hebben gebruikt, die zowel door EUCAST als door het CLSI zijn aanbevolen. Dit illustreert de noodzaak om laboratoria blijvend te informeren en bij te scholen om de surveillance en het opsporen van nieuwe bacterieresistenties te optimaliseren.
Enkele referentie-artikels die we sterk aanbevelen om er meer over te weten
Olaitan AO, Morand S, Rolain JM. Mechanisms of polymyxin resistance: acquired and intrinsic resistance in bacteria. Front Microbiol. 2014 Nov 26;5:643. doi: 10.3389/fmicb.2014.00643. eCollection 2014. Review.
Bialvaei AZ, Samadi KH. Colistin, mechanisms and prevalence of resistance. Curr Med Res Opin. 2015; 31: 707-21.
Liu YY, Wang Y, Walsh TR et al. Emergence of plasmid-mediated colistin resistance mechanism MCR-1 in animals and human beings in China: a microbiological and molecular biological study. Lancet Infect Dis. 2016; 16: 161-8.
Poirel L, Jayol A, Nordmann P. Polymyxins: Antibacterial Activity, Susceptibility Testing, and Resistance Mechanisms Encoded by Plasmids or Chromosomes.
Clin Microbiol Rev. 2017; 30: 557-96.
Dortet L, Bonnin R, Jousset A et al. Emergence de la résistance à la colistine chez les entérobactéries : une brêche dans le dernier rempart contre la pan-résistance. Journal des Anti-infectieux 2016; 18: 139-59.
Nieuwigheden
Wetenschappelijke agenda
- oktober 2024
-
van 16/10 tot 20/10 || in Los Angeles
SHEA ID week. A joint meeting of IDSA, SHEA, HIVMA, PIDS and SIDP
- november 2024
-
van 20/11 tot 22/11 || in Liverpool
Healthcare infection society
- april 2025
-
van 11/04 tot 15/04 || in Wenen
Congrès de l’ European Society of Clinical Microbiology and Infectious Diseases (ESCMID)
- juni 2025
-
van 4/06 tot 6/06 || in Marseille
35ème Congrès National de la Société Française d’Hygiène Hospitalière (SF2H)
-
van 17/06 tot 18/06 || in Londen
HIS congres (Healthcare Infection Society)




