Serratia marcescens uitbraak in een afdeling neonatale intensieve zorgen: uitbraakonderzoek met behulp van whole-genome sequencing
1. Inleiding
Serratia marcescens heeft het potentieel om uitbraken te veroorzaken in kritieke diensten, hoofdzakelijk neonatale intensieve zorgeenheden (NICU) (1-7). In een Europese multicenterstudie over ziekenhuisinfecties bij pediatrische patiënten blijkt S. marcescens verantwoordelijk te zijn voor 15% van de cultuur-positieve nosocomiale infecties in de NICU (8). Neonaatjes opgenomen in de NICU hebben een hoog risico op het verwerven van ziekenhuisinfecties omwille van hun immatuur immuunsysteem en de medische interventies die ze moeten ondergaan (1, 9). Risicofactoren voor S. marcescens infecties zijn een laag geboortegewicht (<1500 g), prematuriteit (<37 weken), verblijfsduur, kunstmatige beademing en antibioticagebruik (2, 3). Neonaten kunnen langdurig gekoloniseerd zijn ondanks adequate antibiotherapie, hoofdzakelijk ter hoogte van het gastro-intestinaal en respiratoir stelsel (10). Een rigoureuze implementatie van infectiepreventiemaatregelen is dan ook erg belangrijk in de ziekenhuissetting (4, 6).
Snel identificeren van gekoloniseerde en geïnfecteerde patiënten gevolgd door een gerichte implementatie van infectiepreventiemaatregelen zijn cruciaal om de verspreiding van S. marcescens te stoppen (3, 4). Een nieuwe en veelbelovende techniek in het uitbraakonderzoek is whole-genome sequencing (WGS), waarmee het mogelijk is om micro-organismen in detail te typeren met een hogere resolutie dan oudere technieken zoals pulsed-field gel electrophoresis (PFGE) wat de huidige standaardmethode is voor de meeste species waaronder S. marcescens (1, 6, 11). WGS zou gebruikt kunnen worden om de verspreiding in kaart te brengen en potentiële bronnen op te sporen. Daarenboven is de identificatie van antibioticaresistentie- en virulentiegenen mogelijk met deze techniek (1, 11, 12).
Het doel van deze studie is om een uitbraak (2018-2019) van S. marcescens in de neonatale intensieve zorgen van ons ziekenhuis te beschrijven en te bediscussiëren welke maatregelen bijgedragen hebben aan het onder controle brengen ervan. Ter vergelijking werden isolaten van voorgaande veronderstelde uitbraken op de NICU en van hemoculturen afgenomen bij volwassenen geïncludeerd.
Fylogenetische links werden bestudeerd met WGS om het potentieel van deze tool in uitbraakonderzoek na te gaan.
2. Materialen en methoden
2.1 Setting
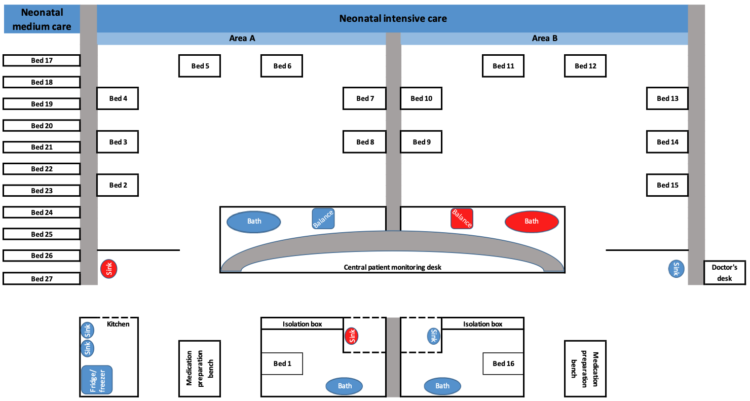
Het UZ Brussel is een tertiair ziekenhuis met meer dan 700 bedden. De dienst neonatologie bestaat uit een intensieve zorgeenheid (NICU) met 16 bedden en een niet-intensieve zorgeenheid met 11 bedden. De afdeling telt jaarlijks een 350-tal opnames. De NICU is opgedeeld in twee zalen voor telkens acht patiënten (Fig. 1). De niet-intensieve zorgeenheid is gescheiden van de NICU, maar de zorgverlening op beide eenheden gebeurt door hetzelfde team van zorgverleners.
Fig. 1 Weergave van de dienst neonatologie van het Universitair Ziekenhuis Brussel. De omgevingsoppervlakken waar S. marcescens isolaten geïsoleerd werden zijn in het rood weergegeven (n=4).
2.2 Patiënten en stalen
Routinematig worden geen surveillancekweken afgenomen op de NICU, screeningsstalen (oraal en rectaal) en omgevingsstalen worden afgenomen bij (verdenking van) een uitbraak. Surveillancekweken worden afgenomen met een ESwab® (Copan, Brescia, Italy). De studie bestond uit verschillende subgroepen.
• Patiëntisolaten van de NICU uitbraak in 2018-2019 (n=36) :
– screeningstalen (oktober 2019-maart 2020);
– klinische stalen afgenomen sinds de start van de uitbraak tot het einde van de surveillanceperiode
(augustus 2018-maart 2020).
• Omgevingsisolaten van de NICU uitbraak in 2018-2019 (n=4)
• Patiëntisolaten van twee voorgaande veronderstelde NICU uitbraken:
– screeningstalen en klinische stalen (mei 2014-augustus 2015) (n=12);
– klinische stalen (januari-december 2017; geen screening opgestart) (n=3).
• Alle S. marcescens isolaten van hemoculturen afgenomen bij volwassenen in 2019 (n=8) werden geïncludeerd om na te gaan of het om een ziekenhuisbreed probleem ging.
Er werd slechts één isolaat per patiënt geanalyseerd, uitgezonderd voor een volwassene met twee episodes van bacteriemie (hemoculturen afgenomen met zeven maanden tussentijd).
Ethische goedkeuring werd verkregen van de Commissie Medische Ethiek van UZ Brussel (B.U.N 1432020000001).
2.3 Whole-genome sequencing
Het genomisch DNA werd geëxtraheerd uit de S. marcescens isolaten met de Maxwell RSC Cell DNA purification kit op het Maxwell RSC Instrument (Promega Corporation, Madison, Wisconsin, USA). Fragmentatie van genomisch DNA werd uitgevoerd met de NEBNext® Ultra™ II FS module. Sequencing libraries, met een insert grootte van gemiddeld 550 bp (2×250 read lengte), werden voorbereid met de KAPA Hyper Plus kit (Kapa Biosystems, Wilmington, Massachusetts, USA) en een Pippin Prep size selection. Om PCR bias te vermijden werd geen PCR amplificatiestap uitgevoerd en werd een 500 ng input van genomisch DNA gebruikt. Na equimolaire pooling werden libraries gesequenced met een Novaseq 6000 instrument (Illumina, San Diego, California, USA) gebruikmakend van een SP-type flow cel met 500 cycli. Hiertoe werd de library gedenatureerd en verdund volgens de instructies van de fabrikant. Een 1% PhiX controlebibliotheek werd geïncludeerd in elke sequencing run. De sequentie kwaliteit werd bepaald met FastQC (versie 0.11.4) software (https://www.bioinformatics.babraham.ac.uk/projects/fastqc/). ‘De novo’ assemblage werd uitgevoerd met SPAdes genome assembler (http://bioinf.spbau.ru/spades).
2.4 wgMLST analyse
De sequeneringsgegevens werden geanalyseerd met het whole-genome multilocus sequence typing (wgMLST) schema voor S. marcescens dat beschikbaar is in BioNumerics versie 7.6.3 (Applied Maths, Biomérieux, Belgium). Dit schema bestaat uit 9,377 loci (6). Beide assemblage algoritmes werden gebruikt voor allele calling, i.e. de ‘assembly-free’ k-mer gebaseerde aanpak gebruikmakend van raw reads en de ‘assembly-based’ BLAST aanpak. De standaardinstellingen werden gebruikt voor beide, de ‘assembly-free’ en ‘assembly-based’ algoritmes. De kwaliteit van de sequentie read sets, de ‘de novo’ assemblies, de ‘assembly-free’ en de ‘assembly-based’ allele calls werden gecontroleerd gebruikmakend van het statistiekvenster in BioNumerics. Minimal spanning trees werden gemaakt met de wgMLST allelische profielen als input data in BioNumerics. De lengte van de vertakkingen zijn een weerspiegeling van het aantal allelen verschil tussen de isolaten in de knooppunten. De maximum afstand tussen de nodules om te spreken van clustering werd ingesteld op 19 (6).
3. Resultaten
3.1 Epidemiologisch uitbraakonderzoek
In april 2019 werd de dienst ziekenhuishygiëne gealarmeerd nadat S. marcescens in éénzelfde week geïsoleerd werd uit de stalen van drie NICU-patiënten (hemoculturen, n=2; bronchusaspiraat, n=1). Gebaseerd op de prevalentie van
S. marcescens in NICU-patiënten leek er een probleem te zijn sinds augustus 2018, met een lichte afname begin 2019, gevolgd door een tweede piek in het voorjaar van 2019.
Een uitbraakonderzoek werd opgestart. De gevalsdefinitie werd beschreven als alle neonaten opgenomen in de NICU sinds augustus 2018, die geïnfecteerd/gekoloniseerd waren met
S. marcescens (Fig. 2).
Fig. 2 : Uitbraakcurve (maandelijkse incidentie) van S. marcescens infectie/kolonisatie in de NICU van het Universitair Ziekenhuis Brussel (mei 2018-maart 2020; n=36).
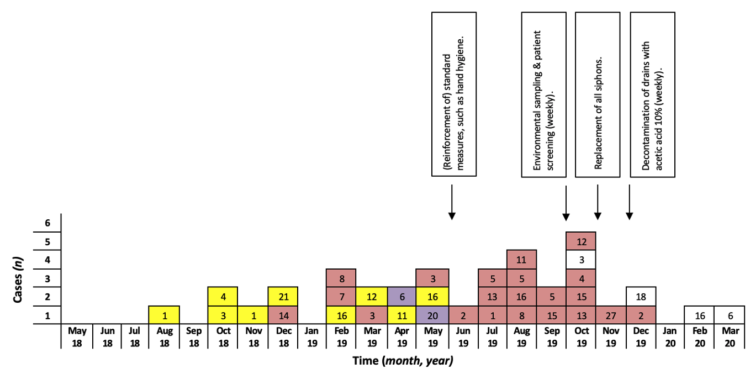
Aan de hand van de pijlen worden de tijdstippen aangeduid waarop infectiepreventiemaatregelen geïmplementeerd werden.
De kleuren van de vierkantjes komen overeen met de kleuren van de verschillende uitbraakclusters zoals weergegeven in Fig. 3; de witte vierkantjes zijn gevallen die niet tot een van de uitbraakclusters behoren. De getallen in de vierkantjes geven de bedden weer waarin de neonaten opgenomen waren op het moment van staalname.
Tussen augustus 2018 en maart 2020 raakten 36 NICU-patiënten geïnfecteerd/gekoloniseerd met S. marcescens. Ze verbleven in verschillende bedden en zelfs verschillende delen van de afdeling (cfr. Fig. 1, de afdeling is opgedeeld in twee zalen) op het moment van de eerste positieve cultuur (Fig. 2). Dit heeft geleid tot de hypothese van een gemeenschappelijke bron in de omgeving en/of transmissie tussen de neonaten via (de handen van) zorgverleners en ouders.
Volgende omgevingsoppervlakken werden bemonsterd; echografiegel (n=1); filters van badkranen (n=4); filters van douchekoppen (n=4); douchekop (n=1); afvoer van baden (n=4); afvoer van lavabo’s (n=6); thermometer (n=1); handzeep (n=2); reinigingsolie (n=2); couveuses (n=4); borstpompen (n=6); zetels (n=12); verzorgingskussen (n=1); baby weegschaal (n=1); doos van desinfecterende doekjes (n=2); oppervlakken in isolatiekamers (n=20); high-touch oppervlakken van melkfrigo (n=3); en diepvries (n=2); melkflesje van neonaten gekoloniseerd met S. marcescens (n=2); poeder ter verrijking van moedermelk (n=1); sojaolie (n=1).
Vier omgevingsstalen bleken positief te zijn voor S. marcescens (Fig. 1) :
• de afvoer van de lavabo in zaal A (staalname 09/10/2019
• de afvoer van het bad in zaal B (staalname 09/10/2019)
• de weegschaal in zaal B (staalname 16/10/2019)
• de afvoer van de lavabo in isolatiekamer 1 (staalname 09/10/2019)
In totaal werden 63 S. marcescens isolaten (patiënten, n=59; omgeving, n=4) geïncludeerd voor WGS en wgMLST analyse. Op basis hiervan werden vijf clusters onderscheiden (Fig. 3).
De veronderstelde uitbraak in 2018-2019 bleek te bestaan uit drie afzonderlijke clusters. Cluster 1 bestond uit 24 isolaten (patiënten, n=21; omgeving, n=3), verschillend in 0 tot 13 allelen. De omgevingsisolaten werden gevonden ter hoogte van de afvoer van de lavabo in zaal A en de weegschaal en afvoer van het bad in zaal B. Cluster 2 bestond uit isolaten van twee patiënten en een isolaat gevonden ter hoogte van de afvoer van de lavabo in isolatiekamer 1. De isolaten van deze cluster verschilden in slecht 0 tot 1 allel van elkaar. Opvallend is dat beide patiënten gelijktijdig verbleven in de NICU, maar niet opgenomen werden in deze isolatiekamer gedurende hun verblijf. Cluster 3 bestond uit negen patiëntisolaten, verschillend in 0 tot 8 allelen. Geen enkel van de omgevingsstalen kon gelinkt worden aan deze cluster. De S. marcescens stammen gevonden in stalen die afgenomen werden na 25 december 2019 (patiënten, n=3) waren significant verschillend van de uitbraakstammen en van elkaar, wat aangeeft dat de uitbraak gestopt was.
De S. marcescens isolaten van hemoculturen afgenomen bij volwassenen (n=8) konden niet gelinkt worden aan elkaar, noch aan een van de NICU-uitbraakstammen. De volwassen patiënten waren opgenomen in zes verschillende afdelingen.
Een lichte toename in de prevalentie van S. marcescens in de NICU eind 2016-begin 2017 leek te wijzen op een uitbraak, maar de drie isolaten die geïncludeerd werden van 2017 konden niet gelinkt worden aan elkaar, noch aan een van de uitbraakstammen.
In 2014 konden twee clusters onderscheiden worden: cluster 4 met zeven patiëntisolaten (aantal allelen verschil: 0-2) en een kleinere cluster 5 met twee patiëntisolaten die niet onderscheiden konden worden van elkaar met wgMLST. Drie NICU isolaten van 2015 waren niet gelinkt aan een van de uitbraakstammen, noch aan elkaar.
S. marcescens veroorzaakte hoofdzakelijk kolonisatie gedurende deze uitbraken, een minderheid van de patiënten vertoonde een infectie [cluster 1, 7/21 patiënten (33%); cluster 2, 1/2 (50%); cluster 3, 2/9 (22%); cluster 4, 2/7 (29%); cluster 5, 0/2 (0%)]. Het ging overwegend om luchtweginfecties (n=7), maar ook bacteriëmie (n=4) en een centraal zenuwstel infectie (n=1) werden geobserveerd. In totaal overleden drie patiënten behorend tot de uitbraakclusters als gevolg van de S. marcescens infectie (een van elk van volgende clusters: 1, 3 en 4). Ter vergelijking, de aanwezigheid van S. marcescens in neonaten die niet behoorden tot een uitbraakcluster (n=10) was in evenveel gevallen te wijten aan kolonisatie als aan infectie. Ook in deze groep ging het meestal om een luchtweginfectie (n=3), naast bacteriëmie (n=1) en een urineweginfectie (n=1). Er werden geen overlijdens geobserveerd in deze groep.
Fig. 3 Minimum spanning tree voor alle S. marcescens isolaten (n=63), met aanduiding van het jaar van isolatie.
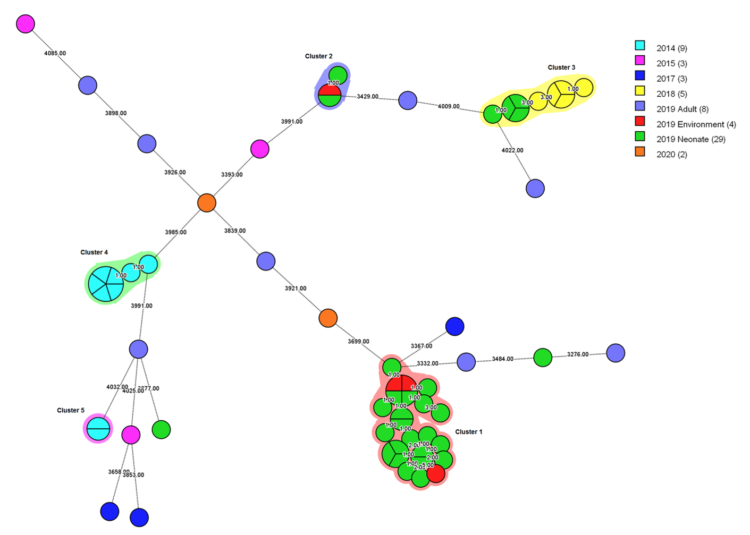
De kleuren rond de cirkels geven de epidemiologische clusters aan. De grootte en de onderverdelingen van de cirkels komen overeen met het aantal isolaten per type. De getallen op de vertakkingen geven het aantal allelen verschil aan tussen de isolaten die ze verbinden.
3.2 Maatregelen infectiepreventie en -beheersing
De dienst infectiepreventie observeerde kritisch de procedures van zowel interne als externe zorgverleners (o.a. kinesitherapeuten, echografisten). De NICU-staf en de externe zorgverleners pasten de handhygiënerichtlijnen niet altijd strikt toe, hoofdzakelijk voor contact met een patiënt werd onvoldoende aandacht besteed aan het uitvoeren van handhygiëne. Ook bleken niet alle ouders voldoende opgeleid te zijn over handhygiëne. Er werd aldus gestart met het benadrukken van het belang van een goede handhygiëne. Ook de desinfectie van (gemeenschappelijk) materiaal en de schoonmaak van de afdeling werden geïntensifieerd.
In oktober 2019 werd gestart met het wekelijks oraal en rectaal screenen van alle neonaten op de NICU. Voor een optimale screening worden een respiratoir en gastro-intestinaal staal gecombineerd, wij opteerden echter voor mondwissers aangezien respiratoire stalen moeilijker af te nemen zijn (10). Zo nodig werden ook klinische stalen afgenomen.
De staf werd niet gescreend, maar ze werden wel opgesplitst in het verzorgen van ofwel geïnfecteerde/gekoloniseerde neonaten, ofwel niet-aangetaste neonaten.
Bij het onderzoeken van omgevingsstalen werd S. marcescens (gelinkt aan cluster 1 en 2) gevonden ter hoogte van de afvoer van een bad en twee lavabo’s. Naar aanleiding hiervan werden alle sifons op de NICU vervangen (baden, n=4; lavabo’s, n=6) en werd een wekelijkse decontaminatie met azijnzuur 10% geïntroduceerd. Men laat de azijnzuur gedurende 30 minuten inwerken alvorens de afvoer gespoeld werd met water.
Na de implementatie van deze maatregelen kon de uitbraak onder controle gebracht worden en werd de surveillance gestopt eind maart 2020 (Fig. 2).
Discussie
We beschreven een uitbraak van S. marcescens in de NICU van ons ziekenhuis aan de hand van WGS en wgMLST analyse en vergeleken de stammen met deze van veronderstelde voorgaande uitbraken.
De uitbraak in 2018-2019 bleek te bestaan uit drie afzonderlijke clusters die tegelijkertijd circuleerden gedurende meerdere maanden. De gelijktijdige aanwezigheid van meerdere klonen werd beschreven in reeds gepubliceerde uitbraakonderzoeken en lijkt te wijzen op de aanwezigheid van meerdere bronnen (1, 4, 13-15).
Omgevingsonderzoek toonde de aanwezigheid van
S. marcescens stammen in de afvoer van een bad en twee lavabo’s (cluster 1, n=2; cluster 2, n=1). De positieve afvoer van cluster 2 bevond zich in de isolatiekamer, maar geen van de patiënten behorend tot deze cluster werd ooit opgenomen in deze kamer. De afvoer kan dus een besmettingsbron geweest zijn in de NICU van ons ziekenhuis, zoals ook het geval was in verscheidene eerder gepubliceerde uitbraakrapporten, maar er moet een vehikel geweest zijn van de afvoer van de lavabo naar de neonaten van uitbraakcluster 2, en er moet ook een andere bron aanwezig geweest zijn gezien geen enkele afvoer gelinkt kon worden aan de stammen van uitbraakcluster 3 (1, 15-17). Gebaseerd op eerder gepubliceerde uitbraken wordt verondersteld dat het belangrijkste reservoir van S. marcescens het gastro-intestinaal stelsel is van de geïnfecteerde/gekoloniseerde neonaten die gedurende een lange periode gekoloniseerd blijven (2, 4, 10). Van hieruit kan kruisbesmetting plaatsvinden via de handen van zorgverleners (3, 4). Maar ook de ouders kunnen transiënt besmet geraken en vervolgens de omgeving besmetten en vice versa. Het is niet mogelijk te weten of de micro-organismen aanwezig in de afvoerbuizen de neonaten gekoloniseerd hebben, of deze aanwezig in de neonaten geleid hebben tot de besmetting van de afvoerbuizen, maar onze hypothese is dat beide optraden als een reservoir voor besmetting via de handen van zorgverleners en ouders (Fig. 4).
Fig. 4 Hypothese van kruisbesmetting bij de S. marcescens uitbraak in de NICU van het Universitair Ziekenhuis Brussel (HCWs= zorgverleners).

Ook in 2014 werden twee gelijktijdige uitbraakclusters geobserveerd, wat aantoont dat S. marcescens uitbraken in de NICU een terugkerend probleem zijn. De stammen van deze clusters verschilden echter significant van deze van de 2018-2019 uitbraakcluster. Er kan dus verondersteld worden dat er geen sprake is van een omgevingsbron die als continu reservoir optreedt. Dit is een bevestiging van de hypothese dat de neonaten, en niet de omgeving, het belangrijkste reservoir en het startpunt zijn van uitbraken.
De stammen van de hemoculturen afgenomen bij volwassenen konden niet gelinkt worden aan elkaar, noch aan de NICU uitbraken. Dit bevestigt de veronderstelling dat we niet te maken hebben met een ziekenhuisbreed probleem, wat rechtvaardigt dat enkel op de NICU striktere infectiepreventiemaatregelen genomen werden. Dit toont ook aan dat neonaten meer vatbaar zijn voor S. marcescens uitbraken dan volwassenen omwille van hun immatuur immuunsysteem en de intensieve medische behandelingen die ze moeten ondergaan (1, 9).
Als antwoord op de uitbraak werden meerdere maatregelen genomen in verschillende stappen (Fig. 2). We zijn gestart met het intensifiëren van de standaardvoorzorgsmaatregelen zoals goede handhygiëne. Aangezien de bacterie overgedragen wordt via de handen is het evident dat het naleven van een goede handhygiëne de belangrijkste maatregel was om transmissie te voorkomen (2-4, 13, 18). Het opnieuw opleiden van de zorgverleners is een effectieve maatregel gebleken in voorgaande uitbraken (2, 4, 13, 14, 18, 19). Daarenboven hebben we de ouders opgeleid over goede handhygiëne aangezien het aannemelijk is dat ook zij een rol spelen in de overdracht. In een volgende stap hebben we een wekelijkse kolonisatiescreening ingevoerd, met het opdelen van de staf in het verzorgen van de besmette neonaten of de niet-besmette neonaten. Daarnaast werd een omgevingsonderzoek uitgevoerd (14, 18). We veronderstellen dat de verspreiding van de S. marcescens stammen van cluster 2 en 3 gestopt werd door de implementatie van deze eerste set van standaardvoorzorgsmaatregelen aangezien geen nieuwe gevallen gedetecteerd konden worden sinds juni 2019. Cluster 1 kon echter niet gestopt worden. Daarom werden vervolgens alle sifons op de NICU vervangen. Deze maatregel werd genomen op basis van voorgaand onderzoek op de volwassen intensieve zorgafdeling van ons ziekenhuis waaruit bleek dat de afvoer van de lavabo een potentiële bron is van (multiresistente) Enterobacteriaceae. Gezien biofilmvorming kan optreden is de bacteriële lading in de sifons erg hoog en kan een aerosol met bacteriën verspreid worden wanneer het water loopt (20). In verschillende NICU uitbraken werden de sifons vervangen om de verspreiding te stoppen (15, 19). Uit voorgaand onderzoek blijkt echter dat het vervangen van de sifons alleen onvoldoende is om de transmissie definitief een halt toe te roepen (15, 20). In een studie van Smolders et al. bleek de decontaminatie van de afvoer met azijnzuur (25%) een goedkope en effectieve maatregel te zijn (21). Een concentratie hoger dan 10% kan echter irritatie veroorzaken bij contact met de huid en de ogen en na inhalatie (22). Omwille van de fragiliteit van de NICU-populatie hebben wij daarom geopteerd voor een wekelijkse decontaminatie van de afvoer met azijnzuur 10%. Na het vervangen van de sifons (november 2019) en introductie van een wekelijkse decontaminatie (december 2019) werd de uitbraak onder controle gebracht. Op 2 december 2019 werd de laatste nieuwe patiënt geobserveerd die geïnfecteerd/gekoloniseerd raakte met een uitbraakstam.
Initieel (augustus 2018-april 2019) werd bij de beschreven uitbraak verondersteld dat het om sporadische S. marcescens gevallen ging bij NICU patiënten. Als WGS eenvoudig toegankelijk zou geweest zijn in ons ziekenhuis, zou dit het snel erkennen van de uitbraak mogelijk bevorderd hebben door aan te tonen dat de stammen tot eenzelfde epidemiologische cluster behoorden. Het omgevingsonderzoek vormde de sleutel naar de mogelijke bronnen die vervolgens gelinkt konden worden aan de verschillende uitbraakclusters door WGS. Op die manier werden de vermoedelijke transmissieroutes opgehelderd en was de implementatie van gerichte maatregelen naast de standaardvoorzorgsmaatregelen mogelijk. De effectiviteit van de maatregelen werd eveneens aangetoond met WGS gezien de S. marcescens stammen geïsoleerd na december 2019 niet meer gelinkt konden worden aan de uitbraakstammen.
De resultaten in deze studie tonen het potentieel van WGS bij uitbraakonderzoek. Tot op heden is WGS echter nog niet breed beschikbaar voor routineonderzoek in klinische laboratoria, gezien de nog steeds hoge kosten van de technologie en de nodige menselijke expertise voor de analyse en interpretaite van de resultaten. Verdere optimalisatie is nodig om de turnaround time in te korten zodat het resultaat bekomen wordt binnen een klinisch relevante tijdspanne. Het opstellen van een gevalsdefinitie, nemen van controlemaatregelen en formuleren van hypotheses dient nog steeds te gebeuren alvorens de typeringsresultaten gekend zijn. Daarenboven dient de kost verder te verminderen en de data-analyse gestroomlijnd te worden om de techniek breed beschikbaar te maken en routinematig te kunnen toepassen bij uitbraakonderzoek (23).
Conclusie
We nemen aan dat beiden, de geïnfecteerde/gekoloniseerde neonaten en de afvoer van lavabo’s/baden, reservoirs waren van S. marcescens waarbij kruisbesmetting zeer waarschijnlijk plaatsvond via de handen van zorgverleners en ouders. Gebaseerd op deze veronderstelling is het aannemelijk dat het naleven van een goede handhygiëne de belangrijkste standaardmaatregel was om de verspreiding te stoppen. Maar definitieve controle van de uitbraak werd pas bereikt na het vervangen en wekelijks decontamineren van de sifons met azijnzuur (10%).
WGS kan een grote meerwaarde betekenen bij uitbraakonderzoek. Het kan helpen in het herkennen van een uitbraak waarbij de verspreiding accuraat in kaart gebracht wordt en potentiële bronnen achterhaald kunnen worden. Dit kan helpen bij de gerichte implementatie van controlemaatregelen. Verdere optimalisatie van de WGS workflow is echter nodig om de turnaround time en de kost te verminderen opdat de techniek routinematig toegepast zou kunnen worden bij uitbraakonderzoek.
Referenties
1. Martineau C, Li X, Lalancette C, Perreault T, Fournier E, Tremblay J, et al. Serratia marcescens Outbreak in a Neonatal Intensive Care Unit: New Insights from Next-Generation Sequencing Applications. J Clin Microbiol. 2018;56(9).
2. Voelz A, Muller A, Gillen J, Le C, Dresbach T, Engelhart S, et al. Outbreaks of Serratia marcescens in neonatal and pediatric intensive care units: clinical aspects, risk factors and management. Int J Hyg Environ Health. 2010;213(2):79-87.
3. Cristina ML, Sartini M, Spagnolo AM. Serratia marcescens Infections in Neonatal Intensive Care Units (NICUs). Int J Environ Res Public Health. 2019;16(4).
4. Montagnani C, Cocchi P, Lega L, Campana S, Biermann KP, Braggion C, et al. Serratia marcescens outbreak in a neonatal intensive care unit: crucial role of implementing hand hygiene among external consultants. BMC Infect Dis. 2015;15:11.
5. Moles L, Gomez M, Moroder E, Jimenez E, Escuder D, Bustos G, et al. Serratia marcescens colonization in preterm neonates during their neonatal intensive care unit stay. Antimicrob Resist Infect Control. 2019;8:135.
6. Rossen JWA, Dombrecht J, Vanfleteren D, De Bruyne K, van Belkum A, Rosema S, et al. Epidemiological Typing of Serratia marcescens Isolates by Whole-Genome Multilocus Sequence Typing. J Clin Microbiol. 2019;57(4).
7. Attman E, Korhonen P, Tammela O, Vuento R, Aittoniemi J, Syrjanen J, et al. A Serratia marcescens outbreak in a neonatal intensive care unit was successfully managed by rapid hospital hygiene interventions and screening. Acta Paediatr. 2018;107(3):425-9.
8. Raymond J, Aujard Y. Nosocomial infections in pediatric patients: a European, multicenter prospective study. European Study Group. Infect Control Hosp Epidemiol. 2000;21(4):260-3.
9. Fattorini M, Buonocore G, Lenzi D, Burgassi S, Cardaci RMR, Biermann KP, et al. Public Health since the beginning: Neonatal incubators safety in a clinical setting. J Infect Public Health. 2018;11(6):788-92.
10. Giles M, Harwood HM, Gosling DA, Hennessy D, Pearce CT, Daley AJ. What is the best screening method to detect Serratia marcescens colonization during an outbreak in a neonatal intensive care nursery? J Hosp Infect. 2006;62(3):349-52.
11. Gilchrist CA, Turner SD, Riley MF, Petri WA, Jr., Hewlett EL. Whole-genome sequencing in outbreak analysis. Clin Microbiol Rev. 2015;28(3):541-63.
12. Abreo E, Altier N. Pangenome of Serratia marcescens strains from nosocomial and environmental origins reveals different populations and the links between them. Sci Rep. 2019;9(1):46.
13. David MD, Weller TM, Lambert P, Fraise AP. An outbreak of Serratia marcescens on the neonatal unit: a tale of two clones. J Hosp Infect. 2006;63(1):27-33.
14. Dawczynski K, Proquitte H, Roedel J, Edel B, Pfeifer Y, Hoyer H, et al. Intensified colonisation screening according to the recommendations of the German Commission for Hospital Hygiene and Infectious Diseases Prevention (KRINKO): identification and containment of a Serratia marcescens outbreak in the neonatal intensive care unit, Jena, Germany, 2013-2014. Infection. 2016;44(6):739-46.
15. Maltezou HC, Tryfinopoulou K, Katerelos P, Ftika L, Pappa O, Tseroni M, et al. Consecutive Serratia marcescens multiclone outbreaks in a neonatal intensive care unit. Am J Infect Control. 2012;40(7):637-42.
16. Mahlen SD. Serratia infections: from military experiments to current practice. Clin Microbiol Rev. 2011;24(4):755-91.
17. McGeer A, Low DE, Penner J, Ng J, Goldman C, Simor AE. Use of molecular typing to study the epidemiology of Serratia marcescens. J Clin Microbiol. 1990;28(1):55-8.
18.Cipolla D, Giuffre M, Mammina C, Corsello G. Prevention of nosocomial infections and surveillance of emerging resistances in NICU. J Matern Fetal Neonatal Med. 2011;24 Suppl 1:23-6.
19. Tracy M, Ryan L, Samarasekara H, Leroi M, Polkinghorne A, Branley J. Removal of sinks and bathing changes to control multidrug-resistant Gram-negative bacteria in a neonatal intensive care unit: a retrospective investigation. J Hosp Infect. 2020;104(4):508-10.
20. De Geyter D, Blommaert L, Verbraeken N, Sevenois M, Huyghens L, Martini H, et al. The sink as a potential source of transmission of carbapenemase-producing Enterobacteriaceae in the intensive care unit. Antimicrob Resist Infect Control. 2017;6:24.
21. Smolders D, Hendriks B, Rogiers P, Mul M, Gordts B. Acetic acid as a decontamination method for ICU sink drains colonized by carbapenemase-producing Enterobacteriaceae and its effect on CPE infections. J Hosp Infect. 2019;102(1):82-8.
22. Rijksinstituut voor Volksgezondheid en Milieu. De risico’s van azijn bij de bestrijding van onkruid en groene aanslag door particulieren [Internet] . 2019 [cited 12 February 2020]. Available from: https://www.rivm.nl/bibliotheek/rapporten/2019-0198.pdf.
23. Rossen JWA, Friedrich AW, Moran-Gilad J, ESCMID Study Group for Genomic and Molecular Diagnostics (ESGMD). Practical issues in implementing whole-genome-sequencing in routine diagnostic microbiology. Clin Microbiol Infect. 2018;24(4):355-360.
Nieuwigheden
Wetenschappelijke agenda
- maart 2024
-
28/03
BICS Symposium
- april 2024
-
van 8/04 tot 11/04 || in Edinburgh
The Microbiology Society Annual Conference
-
van 23/04 tot 24/04 || in Birmingham
Infection and Prevention Control (IPC)
-
van 27/04 tot 30/04 || in Barcelona
34th European Congress of Clinical Microbiology and infectious diseases
- mei 2024
-
van 16/05 tot 17/05 || in Louvain-La-Neuve
18ème Rencontre Internationale Francophone des Infirmiers et Infirmières (RIF)



