Principaux résultats du rapport EARS-Net 2017

Le Réseau européen de surveillance de la résistance aux antimicrobiens (EARS-Net) est un programme de surveillance qui rassemble des données concernant la résistance aux antimicrobiens acquise au niveau européen. Il fait appel aux réseaux de surveillance des États membres européens. L’Institut scientifique de santé publique (ISP-WIV) organise cette surveillance pour la Belgique (EARS-Net BE) et demande chaque année des données auprès des laboratoires cliniques. EARS-Net BE recense, standardise, valide et communique les données belges et les transmet à l’Europe conformément au protocole de l’ECDC1,2. Le présent article offre un aperçu des principaux résultats de la surveillance EARS-Net BE pour l’année 2016. Vous trouverez de plus amples détails et une discussion approfondie des méthodes et résultats dans le rapport annuel 2017 EARS-Net BE3.
En 2016, 31 des 102 laboratoires hospitaliers belges ont fourni sur une base volontaire des données sur la résistance aux antimicrobiens de 8 pathogènes à EARS-Net BE3. Pour les isolats de Streptococcus pneumoniae, ces données ont été obtenues à partir de la surveillance des infections à pneumocoques en Belgique par le Centre National de Référence UZ Leuven (CNR, KUL), à laquelle 97 des 139 laboratoires cliniques ont participé (70 %)4. La surveillance EARS-NET repose sur des isolats invasifs, c’est-à-dire isolés du sang ou du fluide cérébro-spinal du patient. Voici les pathogènes concernés : Staphylococcus aureus, Streptococcus pneumoniae, Escherichia coli, Klebsiella pneumoniae, Enterococcus faecalis, Enterococcus faecium, Pseudomonas aeruginosa et Acinetobacter baumannii. L’étude de prévalence ponctuelle (EPP) des infections liées aux soins et de l’utilisation des antibiotiques dans les hôpitaux aigus, organisée par l’ECDC et réalisée par l’ISP-WIV en 2011, a confirmé que ces pathogènes étaient en effet les bactéries les plus fréquentes dans les infections nosocomiales en Belgique5. Les résultats de l’ECDC soulignent l’importance des mêmes pathogènes au niveau européen6.
En 2016, nous avons observé une hausse depuis 2012 de la résistance aux antimicrobiens d’Escherichia coli aux céphalosporines (+3,6 %) et aux fluoroquinolones de troisième génération (5,1 %), donnant lieu à des pourcentages de résistance moyens de respectivement 10,5 % (392/3737) et 24,5 % (946/3854). Une tendance croissante depuis 2012 a également été observée pour la résistance aux antimicrobiens de Klebsiella pneumoniae aux céphalosporines (+6,4 %) et aux carbapénèmes (+1,7 %), donnant lieu à des pourcentages de résistance moyens en 2016 de respectivement 22,9 % (153/669) et 2,4 % (16/669) (figure 1). Près de 91 % (10/11) des isolats K. pneumoniae résistant aux carbapénèmes étaient producteurs de carbapénèmase. Des bêta-lactamases à spectre élargi (BLSE) ont été décelés dans 83,5 % (96/115) des échantillons testés qui étaient résistants aux céphalosporines de troisième génération.
Dans le cas de Pseudomonas aeruginosa, une résistance à pratiquement tous les groupes antimicrobiens a été observée. La plus fréquente était celle aux fluoroquinolones (14,5 % (53/366)), suivie par la résistance aux aminoglycosides (11,0 % (36/327)), au pipéracilline/tazobactam (9,8 % (31/318)) et aux carbapénèmes (9,6 % (35/365)). Les niveaux de résistance les plus élevés des variétés d’Acinetobacter baumannii ont été observés par rapport aux fluoroquinolones (7,7 % (6/78)), suivis par l’aminoglycoside amikacine (4,1 % (3/73)) et les carbapénèmes (2,6 % (2/78)). Des tendances à la résistance sont difficiles à identifier pour ces pathogènes, au vu de la taille restreinte de l’échantillon.
Dans le cas de Streptococcus pneumoniae, en marge des macrolides (% de souches résistantes intermédiaires + souches résistantes = 15,9 % (211/1327)), la non-sensibilité était rare : 0,4 % (5/1327) des échantillons n’étaient pas sensibles aux pénicillines ou céphalosporines de troisième génération, et 0,2 % (2/1327) n’étaient pas sensibles aux fluoroquinolones. Pendant la période 2012-2016, on a assisté à la baisse d’une tendance marquée de la non-sensibilité aux macrolides (-9,2 %).
En 2016, 12,2 % (166/1364) des isolats Staphylococcus aureus testés n’étaient pas sensibles à la méticilline (SARM) et 12,7 % (167/1319) étaient résistants aux fluoroquinolones. Pour les deux groupes antimicrobiens, nous avons observé une tendance à la baisse entre 2012 et 2016 (respectivement -4,3 % et -9,0 %, figure 2). Pour le SARM, la diminution constatée jusqu’en 2015 ne s’est pas poursuivie en 2016.
La résistance à la gentamicine est fréquemment apparue pour Enterococcus faecalis (19,8 % (65/328)) et Enterococcus faecium (19,7 % (42/213)). Nous avons observé une tendance à la baisse pour les deux pathogènes en ce qui concerne la résistance de haut niveau à la gentamicine entre 2012 et 2016 (respectivement -4,9 % et -9,1 %). E. faecalis était résistant aux aminopénicillines dans 0,4 % (2/461) des échantillons, tandis que la résistance de E. faecium par rapport à ce groupe de substances antimicrobiennes était de 85,7 % (246/287).
Nous aimerions citer comme principale conclusion la production de carbapénémase des Enterobacteriaceae (CPE), surtout en ce qui concerne K. pneumoniae. L’enzyme carbapénémase est capable d’hydrolyser la plupart des bêta-lactamines ce qui signifie que les options de traitement se limitent à quelques antibiotiques alternatifs (souvent toxiques) qui préservent leur activité, comme la colistine, la tigécycline, la fosfomycine et la gentamicine7,8. L’utilisation des carbapénèmes est en hausse dans de nombreux pays en raison de l’augmentation des Enterobacteriaceae productrices d’ESBL, ce qui donne au final lieu à une augmentation de la résistance. Les informations relatives à la CPE dans l’UE restent limitées, mais les chiffres démontrent que la CPE continue de s’étendre dans les États membres de l’UE, créant une situation problématique concernant K. pneumoniae9. Nous encourageons dès lors la notification de la résistance aux carbapénèmes et de l’activité de carbapénèmase dans K. pneumoniae, mais aussi dans E. Coli, P. aeruginosa et Acinetobacter spp. Une participation accrue à EARS-Net en général est également indiquée pour augmenter la taille des échantillons, surtout dans le cadre du suivi de la résistance des espèces P. aeruginosa et Acinetobacter baumannii . Nos estimations gagneront ainsi en précision et les possibilités de détection de la tendance de résistance s’amélioreront.
En 2016, 65 % des laboratoires participants ont suivi les directives EUCAST10. L’utilisation de différentes directives donne lieu à une variabilité des résultats. Pour les prochains recueils de données d’EARS-Net BE, nous voulons dès lors inciter les laboratoires à également soumettre les résultats quantitatifs des tests de sensibilité (càd les CMI) en plus des interprétations de la sensibilité) dans le but d’améliorer la normalisation des résultats nationaux de la résistance aux antimicrobiens. À partir de 2017, des isolats d’échantillons d’urines seront également ajoutés à la surveillance belge. Nous encourageons également l’harmonisation des définitions des cas et données à utiliser pour la surveillance nationale de la résistance aux antimicrobiens en Belgique, et ce afin de diminuer la charge de travail et d’augmenter la validation interne.
Références
1. European Centre for Disease Prevention and Control. TESSy – The European Surveillance System. EARS-Net reporting protocol 2017. ECDC (2017). Available at: https://ecdc.europa.eu/sites/portal/files/documents/EARS-Net-reporting-protocol-2017.pdf. (Accessed: 28th November 2017)
2. Mertens, K. EARS-Net Belgium 2016 protocol: Including data call, instructions for participating laboratories, data definition, reporting procedure. (Version 7, 6/7/2017). WIV-ISP (2017). Available at: http://www.nsih.be/download/EARSNet_BE_2016_v7.pdf. (Accessed: 29th November 2017)
3. Struyf, T. & Mertens, K. European Antimicrobial Resistance Surveillance Network (EARS-Net) Belgium. Annual report 2017 (data referring to 2016). WIV-ISP (2017). Available at: http://www.nsih.be/download/2017_EARS_NationalReport_Belgium.pdf. (Accessed: 29th November 2017)
4. VERHAEGEN, J. Surveillance van de pneumokokkeninfecties in België . Verslag voor 2016 . 1565, (2017).
5. ECDC. Point Prevalence Study of healthcare associated infections and antimicrobial use in acute care hospitals, Belgium. ECDC (2011). Available at: http://www.nsih.be/download/ECDC PPS/PPS2011ECDCBelgium.pdf. (Accessed: 29th November 2017)
6. ECDC. Point Prevalence Study (ECDC PPS) of healthcare associated infections and antimicrobial use in European acute care hospitals 2011-2012. ECDC (2012). Available at: https://ecdc.europa.eu/sites/portal/files/media/en/publications/Publications/healthcare-associated-infections-antimicrobial-use-PPS.pdf. (Accessed: 29th November 2017)
7. ECDC. The bacterial challenge : time to react. Reproduction 6 July 201, (2009).
8. European Centre for Disease Prevention and Control. Antimicrobial resistance surveillance in Europe 2015. Annual Report of the European Antimicrobial Resistance Surveillance Network (EARS-Net). ECDC (2016). doi:10.2900/39777
9. Albiger, B., Glasner, C., Struelens, M. J., Grundmann, H. & Monnet, D. L. Carbapenemase-producing Enterobacteriaceae in Europe: assessment by national experts from 38 countries, May 2015. Eurosurveillance 20, 30062 (2015).
10. European Centre for Disease Prevention and Control. Antimicrobial resistance surveillance in Europe 2016. Annual Report of the European Antimicrobial Resistance Surveillance Network (EARS-Net). ECDC 1–88 (2017). Available at: https://ecdc.europa.eu/sites/portal/files/documents/AMR 2016_Final-with-cover-for-web-2017.pdf. (Accessed: 28th November 2017)
Figure 1 : Tendance de la résistance aux carbapénèmes et fluoroquinolones et aux céphalosporines et aminoglycosides, EARS-Net BE 2012-2016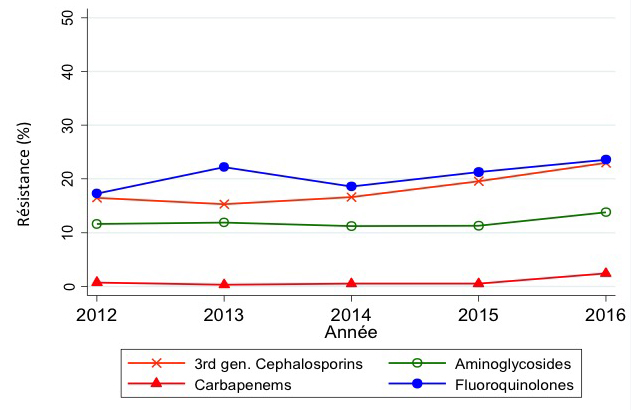
Figure 2 : Staphylococcus aureus: tendance de la non-sensibilité à la méticilline (SARM) et tendance de la résistance aux fluoroquinolones, EARS-Net BE 2012-2016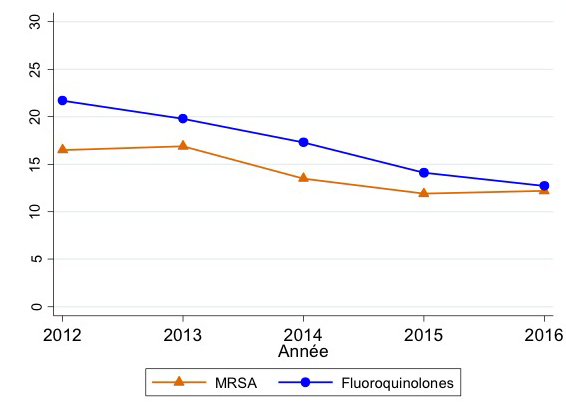
Nouveautés
Agenda scientifique
- mars 2024
-
28/03
Symposium BICS
- avril 2024
-
du 8/04 au 11/04 || à Edinburgh
The Microbiology Society Annual Conference
-
du 23/04 au 24/04 || à Birmingham
Prévention et Contrôle des infections (IPC)
-
du 27/04 au 30/04 || à Barcelone
34th European Congress of Clinical Microbiology and infectious diseases
- mai 2024
-
du 16/05 au 17/05 || à Louvain-La-Neuve
18ème Rencontre Internationale Francophone des Infirmiers et Infirmières (RIF)


