Prevalentie van asymptomatisch dragerschap van Clostridium difficile bij bewoners van Woon- en Zorgcentra aan de Oostkust van België.
Achtergrond
Clostridium difficile is een Gram-positieve anaërobe sporulerende bacil die voor het eerst werd beschreven in 1935 als deel van de intestinale flora van pasgeborenen. Het klinisch spectrum van een symptomatische Clostridium difficile infectie (CDI) bestaat meestal uit een milde diarree die kan gepaard gaan met buikpijn, koorts en paralytische ileus. Slijm en occult bloed kunnen aanwezig zijn, doch bloederige diarree is zeldzaam. Bij ernstige gevallen kunnen complicaties optreden zoals dehydratatie, electrolytenstoornissen en, in geval van pancolitis, toxisch megacolon met soms een colon-perforatie (1).
Het klinisch spectrum van een symptomatische CDI wordt gemedieerd door de productie van twee toxines die cytotoxisch zijn voor de epitheelcellen van het colon. Het gaat over toxine A of enterotoxine en toxine B of cytotoxine. Een bijkomende vermoedelijke virulentiefactor is het binair toxine dat geproduceerd wordt door sommige stammen, in het bijzonder door de meer virulente stammen zoals BI/NAP1/027. Het binair toxine kan tevens aanwezig zijn in de afwezigheid van toxine A of toxine B (2).
Asymptomatische C. difficile kolonisatie is de situatie waarbij C. difficile wordt gedetecteerd in de afwezigheid van symptomen of infectie. Er wordt verondersteld dat deze gekoloniseerde patiënten zouden beschermd zijn tegen progressie van de infectie omdat ze een verhoogde humorale immuun respons kunnen teweegbrengen tegen de toxines (3). Daarentegen kunnen deze gekoloniseerde patiënten als een infectie reservoir bestempeld worden en zo een risico betekenen voor andere personen (4).
Asymptomatisch dragerschap
Definitie
Volgens onze bronnen is er geen duidelijke definitie voor asymptomatische CDI en de termen “dragerschap” en “kolonisatie” worden veelal door elkaar gebruikt. De definitie voor asymptomatische C. difficile kolonisatie die in onze studie werd gehanteerd, is dan ook de volgende: de afwezigheid van ‘diarree zonder colonoscopische of histopathologische aanwijzingen voor pseudomembraneuze colitis, met detectie van een toxinogene C. difficile, of aanwezigheid van C. difficile toxines in de stoelgang.’
Er bestaat geen sluitend bewijs dat niet-toxinogene stammen aanleiding kunnen geven tot een infectie. Studies betreffende CDI waarbij niet-toxinogene stammen waren betrokken, bleken altijd over gevallen te gaan waarbij de isolaten een mengcultuur vertoonden, waarbij ook toxinogene stammen betrokken waren (5).
Epidemiologie
De prevalentie schattingen van asymptomatische C. difficile kolonisaties verschillen beduidend tussen de verschillende patiëntengroepen (6). Tabel 1 geeft een overzicht gebaseerd op de meeste (recente) publicaties. Bij gezonde personen, zonder risicofactoren voor CDI, bedroeg de prevalentie tussen 0 en 15%. Binnen de acute ziekenhuizen bedroeg de prevalentie bij de geriatrische patiënten tussen de 0.6 en 15%, in het algemeen -zonder de geriatrie- tussen de 4 en 29%.
Veel studies hebben zich toegespitst op de oudere patiënten opgenomen in de zogenaamde ‘Long-Term Care Facilities’ (LTCF) waarbij de prevalenties waarden vertoonden variërende tussen 0 en 51%. Wat betreft de eigenlijke rustoorden zijn de resultaten eerder schaars. In het advies van de Hoge Gezondheidsraad 8365, mei 2008, staat te lezen dat de prevalentie van een C. difficile infectie in woon- en zorgcentra varieert tussen 2.1 en 8.1%, gebaseerd op cijfers van 1993 (1). Meer recentere studies, specifiek gericht op het dragerschap, geven een prevalentie variërende tussen 0 en 10% (7,8).
Tabel 1 : Prevalentie van asymptomatische C. difficile kolonisatie in verschillende populatiies (6)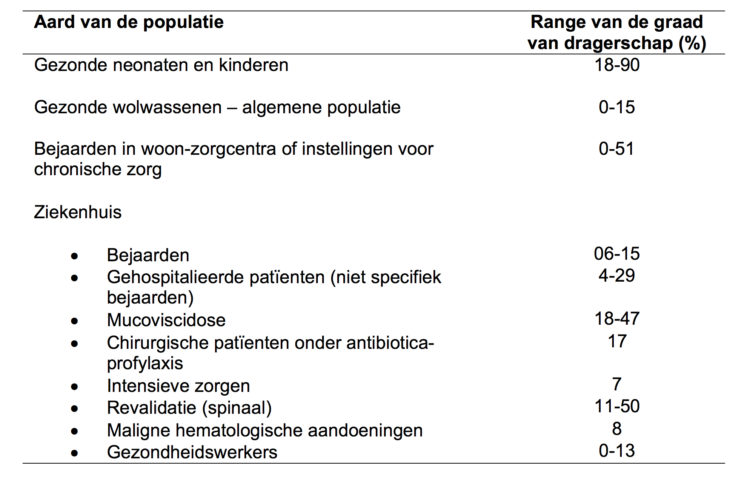
Transmissie vanuit gekoloniseerde patiënten
Persoon-tot-persoon transmissie in ziekenhuisomgevingen, contaminatie van de omgeving en dragerschap op de handen van ziekenhuismedewerkers zijn veelvuldig beschreven in de literatuur. De belangrijkste manieren van transmissie zijn de feco-orale route en direct contact met gecontamineerde oppervlakken (6). Inspanningen ter preventie van transmissie zijn vooral gericht op patiënten met CDI, omdat deze meer C. difficile via de stoelgang verspreiden, met als gevolg een verhoogde huid- en omgevingsbesmetting én contaminatie van de ziekenhuismedewerkers (9).
Daarentegen wordt transmissie tussen gezonde individuen die asymptomatisch zijn gekoloniseerd ook beschreven (10,11). Lanzas et al. toonden aan dat de kans dat een patiënt C. difficile verwerft van een CDI patiënt even groot is als van een asymptomatische patiënt (12). Curry et al. kwamen tot dezelfde bevindingen, waarbij ze 30% van de nieuwe CDI gevallen klasseerden gerelateerd aan andere CDI patiënten en 29% gerelateerd aan gekende asymptomatische C. difficile dragers (13). Andere auteurs spreken van een lagere transmissie graad bij asymptomatische patiënten. McFarland et al. toonden aan dat bij 49% van de symptomatische patiënten de omgeving gecontamineerd was, tegen 29% bij de asymptomatische dragers (14). Dit correspondeert met de bevindingen van een andere studie bij LTCF bewoners, waarbij het aantal positieve culturen het hoogst waren bij huid- en oppervlaktemonsters bij symptomatische patiënten, gevolgd door asymptomatische bewoners en tenslotte het laagst bij niet-gekoloniseerde bewoners (4).
De mogelijkheid tot sporen-vorming maakt een groot verschil tussen de bestrijding van C difficile en andere infectieuze agentia binnen de Infectiepreventie en –Bestrijding (IPB). Sporen kunnen immers lange perioden in de omgeving volharden, terwijl decontaminatie ervan enkel kan gebeuren door agentia op basis van chloor of peroxiden of door UV-licht. Fecale excretie van C difficile sporen kan tot zes weken duren na het verdwijnen van de CD-symptomen (15). Verder toonden Rigss et al. aan dat gekoloniseerde patiënten die geen CDI hadden ontwikkeld tot zes maand lang sporen konden uitscheiden in de omgeving (4).
Risicofactoren voor asymptomatische C. difficile kolonisatie
De tot op vandaag meest significante epidemiologische studie betreffende onderzoek naar de risicofactoren voor ziekenhuisgebonden asymptomatische C. difficile kolonisatie toont aan dat hospitalisatie gedurende de laatste 12 maanden, het gebruik van corticosteroïden, geschiedenis van CDI en de aanwezigheid van antilichamen tegen het toxine B de belangrijkste risicofactoren zijn (16). Gelijkaardige bevindingen zijn beschreven door Loo et al. die chemotherapie, recente hospitalisatie, het gebruik van proton-pomp inhibitoren of histamine H2 antagonisten en de aanwezigheid van antilichamen tegen het toxine B als de belangrijkste risicofactoren aanduidden (17). Deze studie toonde ook aan dat het gebruik van antibiotica (binnen de 8 weken hospitalisatie) wél een risicofactor is voor de ziekenhuisgebonden CDI, maar niet voor ziekenhuisgebonden asymptomatische C. difficile kolonisatie. Deze discrepantie kan er dus op wijzen dat de disruptie van de intrinsieke intestinale microbiota te wijten aan de toediening van antibiotica geen sleutelrol speelt voor C. difficile kolonisatie, terwijl dit voor progressie naar CDI wél het geval is. Het verstoren van de kolonisatieresistentie, waarbij de microbiota samen met verbindingen die de bacteriële proliferatie inhiberen het individu beschermen tegen ziekten veroorzaakt door pathogene organismen, is inderdaad de meest significante factor die leidt tot CDI (18). De belangrijkste factoren die de intestinale flora kunnen verstoren zijn antibiotica, proton-pomp inhibitoren en chemotherapeutica (17). Andere gastheer-gemedieerde factoren die de overgang naar CDI kunnen bevorderen, zijn de leeftijd, comorbiditeiten, een onderdrukt immuunsysteem en een dense intestinale co-kolonisatie met enterokokken (19).
Er bestaat substantieel bewijs dat asymptomatische C. difficile kolonisatie een beschermend effect heeft tegen de progressie naar CDI door een immuun gemedieerde respons. Kyne et al. toonden aan dat bij kolonisatie de IgG levels hoger waren bij asymptomatische C. difficile gekoloniseerde patiënten dan bij deze patiënten die evolueerden naar CDI (20).
Data over de risicofactoren voor C. difficile kolonisatie bij gezonde personen zijn schaars. Groepen die een verhoogd risico vertonen zijn de landbouwers, terwijl ook werd aangetoond dat personen die regelmatig in een meer zwemmen een verhoogde kans maken op kolonisatie (21).
Methoden
Daar uit de literatuur blijkt dat een groot deel van de nieuwe CDI-gevallen, al dan niet binnen het ziekenhuis, resulteert uit transmissie vanuit asymptomatische dragers was het doel van deze studie om de prevalentie van asymptomatische C. difficile dragers bij de bewoners van Woon- en Zorgcentra te bepalen, dit specifiek in de regio van de Oostkust van België. Deze dragers kunnen niet enkel een bron zijn om medebewoners te koloniseren of te infecteren, maar kunnen tevens een potentieel gevaar betekenen voor andere patiënten wanneer ze in het ziekenhuis worden opgenomen. Door de hoge leeftijd van deze groep is de kans immers groot dat dit gebeurt. Bovendien zijn binnen deze groep ook vele risicofactoren aanwezig voor een C. difficile kolonisatie.
In onze studie werden verschillende woon- en zorgcentra (WZC) van de Oostkust van België aangeschreven om mee te werken aan een anoniem onderzoek. Enkel de vaste faeces-stalen werden weerhouden, behorende tot de Bristol Stool Chart categorieën één t.e.m. vier. Stalen van bewoners die de laatste drie maanden in een ziekenhuis werden opgenomen, werden geëxcludeerd. In totaal werden 302 faeces-stalen verzameld. De stalen waren afkomstig van WZC Tilia Maldegem, WZC Huis aan Zee Blankenberge, VZW bejaardenzorg Polderzicht Blankenberge, VZW Bejaardenzorg De Lindeboom Knokke-Heist , AV Het Dak en OLV Van Troost, Knokke-Heist, Westkapelle. De stalen waren afkomstig van 72 mannen en 230 vrouwen. De gemiddelde leeftijd bedroeg 76.6 jaar voor de mannen (64-89) en voor de vrouwen 86.2 jaar (64-99). De totale gemiddelde leeftijd bedroeg 83.9 jaar (64-99).
Er werd gebruik gemaakt van vijf verschillende methoden om de stalen te testen. Deze methoden waren: de kweek (ChromIDTM, bioMérieux), de CerTest van Biotec, Liaison® XL van DiaSorin, mini VIDAS® van bioMérieux en GeneXpert® van Cepheid. Een staal dat bij alle methoden een negatief resultaat gaf, werd bij het risicohoudend afval gegooid. Bij elk positief resultaat, voor zowel GDH (glutamaat dehydrogenase) als toxines, of bij een discordantie, werd een PCR-test uitgevoerd op de GeneXpert. Alle stalen die voor minstens één methode positief waren voor toxines, werden opgestuurd naar het nationaal referentiecentrum voor Clostridium difficile (UCL), waar ze opnieuw in kweek werden gezet en er onderzoek werd gedaan naar het cytopathogeen effect (CPE).
Naast het rechtstreeks enten op de ChromIDTM, bioMérieux, werd er ook aangerijkt via een selectieve thioglycolaat aanrijkingsbodem. Na 10 dagen incubatie werden deze culturen overgezet op de ChromIDTM, bioMérieux, en 48 uur anaëroob geïncubeerd bij 37°C.
Resultaten
Op een totaal van 302 onderzochte faeces-stalen waren uiteindelijk 11 culturen positief op Clostridium difficile.
In tabel 2 zien we dat uiteindelijk 5 faecesstalen op 302 als positief konden worden bestempeld. Eén staal typeerde negatief op de GeneXpert® in de stoelgang, maar positief op het CPE op de kolonies, één staal was positief op de GeneXpert® in de stoelgang, zonder CPE op de kolonies. Na overleg met het nationaal referentiecentrum Clostridium difficile (UCL), werd dit staal als positief beschouwd, omdat we vermoeden dat er in dit staal twee verschillende stammen Clostridium difficile aanwezig zijn: een niet toxinogene stam (ribotype UCL379) geïsoleerd uit de kweek en een toxinogene stam die een positief PCR resultaat gaf in de stoelgang. Het ging over de ribotypes UCL379 (niet toxinogeen), UCL16a (EU0 20), 2 x UCL32 (EU 002) en het ribotype UCL16c (EU 207). De prevalentie van het dragerschap van toxinogene Clostridium difficile binnen de Woon- en Zorgcentra van de oostkust van België bedraagt dus 1.7%.
Tabel 2 : Overzicht van de positieve culturen ‘Clostridium difficile’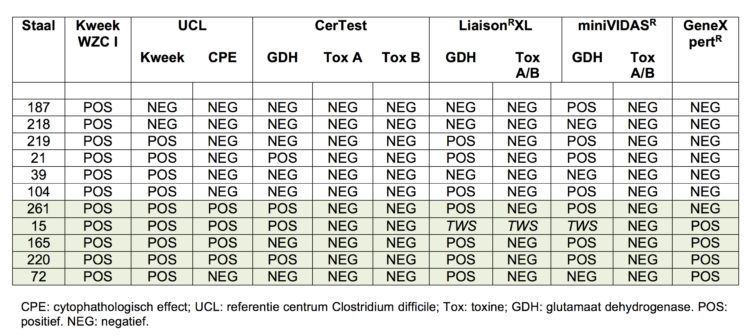
Discussie
De bewoners van de Woon- en Zorgcentra zijn algemeen gesproken een zeer kwetsbare groep. Eerst en vooral is er de leeftijd – de gemiddelde leeftijd bedroeg in deze studie 86.7 jaar – , wat de groep zeer gevoelig maakt voor verschillende factoren die de kolonisatie van Clostridium difficile en de overgang ervan naar CDI kunnen bevorderen. Hospitalisatie, het gebruik van corticosteroïden, het gebruik van antibiotica, de inname van proton-pomp inhibitoren en H2-blokkers, het toedienen van chemotherapeutica, (co)morbiditeiten, een onderdrukt immuunsysteem, zijn factoren die inderdaad meer kunnen optreden naarmate de leeftijd vordert.
Daar uit de literatuur blijkt dat asymptomatische dragers kunnen dienen als een potentieel infectie reservoir voor horizontale transmissie, was de ultieme bedoeling van de studie de prevalentie te bepalen van de grootste risicogroep buiten de opgenomen patiënten binnen het ziekenhuis. De risico’s binnen deze groep zijn inderdaad het grootst, en de kans dat ze binnen afzienbare tijd worden opgenomen in het ziekenhuis is ook reëel. Daarbij komt nog het eigen risico. Alhoewel verschillende studies aantoonden dat asymptomatische TCD dragers een lager risico vertoonden voor het ontwikkelen van CDI dan de niet-dragers, blijken sommige studies het tegendeel te bewijzen. Gupta et al. toonden aan dat 82 van de 1256 onderworpen patiënten asymptomatische dragers waren van C. difficile (6.5%). Twintig patiënten ontwikkelden uiteindelijk CDI, 9 hiervan (45%) waren gekoloniseerde patiënten bij opname (26).
Asymptomatisch dragerschap van Clostridium difficile bij opname binnen het ziekenhuis is goed beschreven in de literatuur met een prevalentie van 0.6 – 13%. Hierbij moet worden opgemerkt dat veel studies geen onderscheid maken tussen toxinogene (TCD) en niet toxinogene Clostridium difficile stammen (NTCD). Het geeft wel de mogelijkheid om de proportie te bepalen van de TCD isolaten. Deze vertegenwoordigden 52-90% van alle isolaten (23, 24, 25). In onze studie bedroeg de proportie 45% (5/11).
Verschillende studies wijzen ook het tekort aan gebruik van hooggevoelige technieken om de veelal lage concentraties aan te tonen. In deze studie werd gebruik gemaakt van de cultuur-gebaseerde methode die veelal boven de PCR-techniek (gevoeligheid 86%) wordt aanzien (22).
Er werd ook gebruik gemaakt van enkel faeces-stalen, daar over de opbrengst van de anale wissers sterk wordt gediscussieerd in de literatuur. Daarbij werden alle stalen aangerijkt op een selectieve thioglycolaatbodem en daarna terug overgeënt. Alle stalen werden eveneens onderworpen aan een GDH/toxines test, dit met drie verschillende technieken. Alle discordante stalen tenslotte, werden opgestuurd naar het Nationaal Referentiecentrum Clostridium difficile waar ze opnieuw werden gecultiveerd en het mogelijks cytopathogeen effect (CPE) werd onderzocht op de kolonies.
Besluit
Samengevat kan worden gesteld dat ondanks het gebruik van hoogtechnologische methodieken het asymptomatisch dragerschap in onze studie vrij laag lijkt. Deze resultaten van ons werk en van de literatuur tonen dan ook aan dat het asymptomatisch dragerschap een complex geheel is en een blijvende uitdaging vormt voor de gezondheidszorg. Er is geen echte, door iedereen gebruikte, term voor asymptomatische kolonisatie. De tijd tussen het verwerven en de symptomatische ziekte is ongekend, maar wordt geschat op 1-2 weken. Er wordt ook gesuggereerd dat de overgang ook helemaal niet kan gebeuren. Er moet ook rekening gehouden worden met de verschillen in de seizoenen : in de winter is het dragerschap groter. Tenslotte wordt gesteld dat asymptomatisch dragerschap wordt onderschat omdat het onderzoek normaal geen deel uitmaakt van het standaardonderzoek van faeces. Daar we veelal te maken hebben met lage concentraties aan toxines worden deze dan ook veelal niet teruggevonden (22). Dit laatste bleek ook uit onze studie: de toxines werd door geen enkele van de drie gebruikte methoden rechtstreeks gedetecteerd in het faeces-staal.
Ziekenhuizen worden traditioneel beschouwd als de belangrijkste focus van Clostridium difficile kolonisatie. Daarbij staat het ook vast dat Clostridium difficile kolonisatie en infectie meer voorkomt bij oudere patiënten, daar de factoren die deze bevorderen, zoals het verstoren van de darmflora en het verlagen van de immuniteit, juist afhankelijk zijn van de leeftijd. De constante beweging van bewoners/patiënten van woon- en zorgcentra naar ziekenhuizen en omgekeerd kan sowieso de transmissie vergemakkelijken van epidemische en niet-epidemische C. difficile stammen. Alhoewel verdere studies noodzakelijk zijn rond de verhoogde CDI-gevoeligheid binnen de woon- en zorgcentra, los van de factoren die binnen de ziekenhuizen een belangrijke rol spelen, is het niet in-opportuun om beide groepen, zijnde de bewoners van de woon- en zorgcentra en de gehospitaliseerden, voorlopig als één potentieel geheel te beschouwen van mogelijke kolonisatie, infectie en transmissie.
Referenties
1 HGR. Belgische aanbevelingen voor de beheersing en preventie van infecties met Clostridium difficile in acute ziekenhuizen en in woon- en zorgcentra. 2008; 8365.
2 McFarland LV. Implication of the changing face of Clostridium difficile disease for health care practioners. Am J Infect Control 2007; 35:237-53.
3 Shim JK. Primary symptomless colonization by Clostridium difficile and discreased risk of subsequent diarrhea. Lancet 1998; 351:633-6.
4 Riggs MM. Asymptomatic carriers are a potential source for transmission of epidemic and nonepidemic Clostridium difficile strains among long-term care facility residents. Clin Infect Dis 2007; 45: 992-8.
5 Geric B. Binairy Toxin-Producing Large Clostridial Toxin-Negative Clostridium difficile Strains Are Enterotoxic but Do Not Cause Disease in Hamsters. J Infect Dis 2006; 193: 1143-50.
6 Furuya-Kanamori L. Asymptomatic Clostridium difficile colonisation : epidemiology ans clinical implications. BMC Infect Dis 2015; 15:516.
7 Arvand M. High Prevalence of Clostridium difficile Colonisation among Nursing Home Residents in Hesse, Germany. Plos One 2012; 7: e30183
8 Rivera EV. Prevalence of asymptomatic Clostridium difficile colonization in a nursinghome population. A cross-sectional study. J Gend Specif Med 2003; 6: 2730.
9 Tattevin P. Clostridium difficile infections : do we know the real dimension of the problem ? Int Antimicrob Agents 2013; 42: 536-40.
10 Kato H. Colonisation and transmission of Clostridium difficile in healthy individuals examined by PCR ribotyping and pulsed-field gel electrophoresis. J Med Microb 2001; 50: 720-7.
11 Clabots CR. Acquisition of Clostridium difficile by hospititalised patients : evidence for colonised new admissions as a source of infection. J Infect Dis 1992; 166: 561-7.
12 Lanzas C. Epidemiological model for Clostridium difficile transmission in healtcare settings. Infect Control Hosp Epidemiol 2011; 32: 553-61.
13 Curry SR. Use of multilocus variable number of tandem repeats analysis genotyping to determine the role of asymptomatic carriers in Clostridium difficile transmission. Clin Infect Dis 2013; 57: 1094-102.
14 McFarland LV. Nosocomial acquisition of Clostridium difficile infection. N Engl J Med 1989; 320: 204-10.
15 Jinno S. Potential for transmission of Clostridium difficile by asymptomatic acute care patients and long-term care facility residents with prior Clostridium difficile infection. Infect Control HospEpiodemiol 2012; 33: 638-9.
16 Kong LY. Predictors of asymptomatic Clostridium difficile colonisation on hospital admission. Am J Infect Control 2015; 43: 248-53.
17 Loo VG. Host and pathogen factors for Clostridium difficile infection and colonisation. N Engl J Med 2011; 365: 1693-703.
18 Britton RA. Interaction between the intestinal microbiota and host in Clostridium difficile colonisation resistance. Trend Microbiol 2012; 20: 319-9.
19 Ozaki E. Clostridium difficile colonisation in healthy adults: transient colonisation and correlation with enterococcal colonisation. J Med Microbiol 2004; 53: 167-72.
20 Cohen SH. Clinical practice guidelines for Clostridium difficile in adults. Infect Control Hosp Epidemiol 2010; 31:431-55.
21 McNamara SE. Carriage of Clostridium difficileand other enteric pathogens among a 4-H avocational cohort. Zoonoses Public Health 2011; 58: 192-9.
22 Alasmari F. Prevalence and Risk factors for Asymptomatic Clostridium difficile Carriage. Clin Infect Dis 2014; 59: 216-222.
23 Leekha S. Asymptomatic Clostridium difficile colonistion in a tertiary care hospital: admission, prevalence and risk factor. Am J Infect Control 2013; 41: 390-3.
24 Rudensky B. the prevalence and nosocomial acquisition of Clostridium difficile infection and colonisation. N Engl J Med 2011; 365: 1693-703.
25 Schoevaerdts D. Asymptomatic colonization by Clostridium difficile in older adult admitted to geriatric unit: a prospective cohort study. J Am Geriatr Soc 2011; 59: 2179-81.
26 Gupta S. A large prospective North American epidemiologic study of hosptital associated Clostridium difficile colonisation and infection. In: International Clostridium difficile Symposium, Bled, Slovenia; 22 September 2012. Abstract O20.
Nieuwigheden
Wetenschappelijke agenda
- maart 2024
-
28/03
BICS Symposium
- april 2024
-
van 8/04 tot 11/04 || in Edinburgh
The Microbiology Society Annual Conference
-
van 23/04 tot 24/04 || in Birmingham
Infection and Prevention Control (IPC)
-
van 27/04 tot 30/04 || in Barcelona
34th European Congress of Clinical Microbiology and infectious diseases
- mei 2024
-
van 16/05 tot 17/05 || in Louvain-La-Neuve
18ème Rencontre Internationale Francophone des Infirmiers et Infirmières (RIF)



