Les biofilms en milieu hospitalier : quels sont les enjeux pour l’hygiène hospitalière ?
NDLR Même si un des auteurs travaille dans le département R&D d’une société dont les produits sont développés spécifiquement pour la lutte contre le biofilm, le comité de rédaction estime que cet article a été écrit dans un esprit tout à fait scientifique
Introduction
Dans un rapport récent de l’ECRI Institute (un organisme d’avis américain indépendant et sans but lucratif) estimant les dix risques les plus graves pour la santé qui sont liés aux technologies utilisées en médecine, le retraitement (lavage, désinfection) des endoscopes après usage arrive en deuxième position1. C’est un avis qui peut surprendre mais il fait bien écho à plusieurs publications récentes décrivant des épidémies d’infections sévères transmises par des endoscopes 2–4. Et l’usage croissant de ce type d’instrument en médecine, dans bon nombre de disciplines (gastro-entérologie, urologie, pneumologie, ORL…), n’est pas étrangère à ce message d’alerte.
La difficulté de bien laver et décontaminer un endoscope après usage tient essentiellement à leur miniaturisation de plus en plus poussée avec des canaux de plus en plus étroits par lesquels transitent inévitablement, durant l’examen, des liquides biologiques qui forment, à l’intérieur de ces canaux des biofilms.
La notion de biofilm est apparue en médecine dans les dernières décennies du vingtième siècle en relation principalement avec les infections constatées chez les patients ayant reçu un implant chirurgical. Les infections sur implant sont insidieuses, lentes à s’installer mais surtout extrêmement difficiles, voire impossibles à traiter par voie médicamenteuse ; elles induisent dans la majorité des cas une réintervention.
Peu à peu la notion de biofilm s’est étendue à d’autres sphères dans le domaine médical (comme la plaque dentaire ou les infections pulmonaires du patient atteint de mucoviscidose). Mais c’est surtout le concept général de biofilm comme moyen principal de persistance des microorganismes dans la nature qui a été établi durant les quinze dernières années.
Nous allons ici successivement 1) décrire ce qu’est un biofilm 2) identifier les problèmes qu’il peut poser en médecine et 3) évaluer les principales approches permettant de lutter contre lui.
Le biofilm – Définition et processus de développement
Dans la nature, environ 90 % des bactéries adoptent un mode de vie en biofilm 5. Les biofilms sont des communautés de microorganismes, composées de bactéries et/ou moisissures de diverses espèces, se développant sur des surfaces. La croissance d’un biofilm est un processus qui comporte 4 étapes clés 6.
1. Phase d’adhésion.
Dans la nature, tout liquide en contact avec une surface inerte (un galet dans la rivière comme l’émail dentaire dans la bouche…) va entraîner le dépôt à la surface du corps de molécules ou de micro-organismes qu’il contient. C’est un simple phénomène d’adsorption guidé principalement par les propriétés d’hydrophobicité. Les forces qui agissent sont faibles et le phénomène est réversible à ce stade (voir Figure 1 A).
Les molécules adsorbées à la surface (en particulier les protéines) peuvent cependant présenter des structures qui peuvent devenir des cibles spécifiques de fixation pour certaines bactéries (pas toutes) qui possèdent des adhésines de surfaces. Une fois la fixation de ces adhésines sur leur cible établie le lien devient beaucoup plus stable. On sait par exemple que les nombreuses molécules du sang et des sérosités (fibrinogène, fibronectine, vitronectine, etc…) qui se déposent, dès le temps opératoire, sur un implant qu’un chirurgien est en train de placer, présentent des épitopes reconnus de façon privilégiée par les staphylocoques qui possède, par exemple, une protéine de surface SdrG capable d’établir des liens covalents forts avec le fibrinogène 7. La force entre SdrG et le fibrinogène est particulièrement intense, 40 fois supérieure à une interaction hydrophobe classique (2 nN versus 50 pN) 8. Un lien direct entre l’abondance de SdrG à la surface de S. epidermidis et la capacité des souches de cette espèce à adhérer sur des surfaces recouvertes de fibrinogène a pu être démontré 9. La nature physico-chimique et la topographie de la surface rencontrée par les micro-organismes jouent donc un rôle clé dans l’adhérence finale de ces derniers. En particulier, les surfaces microstructurées ou présentant des défauts structurels permettent un meilleur ancrage des bactéries car l’aire d’interaction est plus élevée et les micro-organismes sont protégés contre les forces de cisaillement du liquide 10,11.
2. Multiplication et construction de la matrice du biofilm.
Dès que les conditions environnementales le permettent (température, humidité, éléments nutritifs…) les bactéries se multiplient et forment des micro-colonies (voir Figure 1 B) 12. Un avantage majeur est conféré alors aux bactéries qui ont la propriété d’excréter une matrice protectrice composée de divers polymères extracellulaires (EPS). Cette dernière comprend notamment surtout des polysaccharides mais aussi des protéines, de l’ADN et des lipides. La matrice d’EPS devient alors un composant clé des micro-colonies 13. En effet, son rôle lors de la phase d’accumulation du biofilm est d’assurer la cohésion entre les bactéries qui forment les micro-colonies et de les protéger contre les menaces de l’environnement extérieur, comme, par exemple, les antibiotiques 14 ou les désinfectants 15.
3. Maturation.
La troisième phase, la maturation (voir Figure 1 C), est enclenchée lorsque les micro-colonies atteignent une quantité de biomasse qui génère une hétérogénéité importante au sein du biofilm 16. En effet, la matrice d’EPS limite la diffusion des nutriments et des déchets métaboliques ainsi que la circulation des gaz dans le biofilm (notamment de l’oxygène et l’oxyde nitrique) 17, créant ainsi une multitude de micro-environnements à l’intérieur du biofilm. Les bactéries réagissent à ces conditions changeantes en adaptant leur métabolisme, par exemple, en passant de la respiration à la fermentation en cas de limitation d’oxygène 18. C’est dans ces conditions hétérogènes que se développent les bactéries dites « persistantes » qui affichent une tolérance très élevée aux désinfectants et antibiotiques.
4. Dispersion.
Enfin, à partir d’un certain stade de maturité, le biofilm entre dans une phase de dispersion 19. Les micro-organismes qui composent le biofilm mature sont continuellement relâchés vers l’environnement extérieur (voir Figure 1 D). Ce processus est déclenché de manière contrôlée par l’excrétion d’enzymes ou de peptides capables de déstabiliser la matrice d’EPS 20. Les bactéries sont ainsi libérées de la structure du biofilm pour coloniser une nouvelle niche écologique, sur une autre surface favorable à la complétion d’un nouveau cycle de vie sous la forme d’un biofilm 21,22.
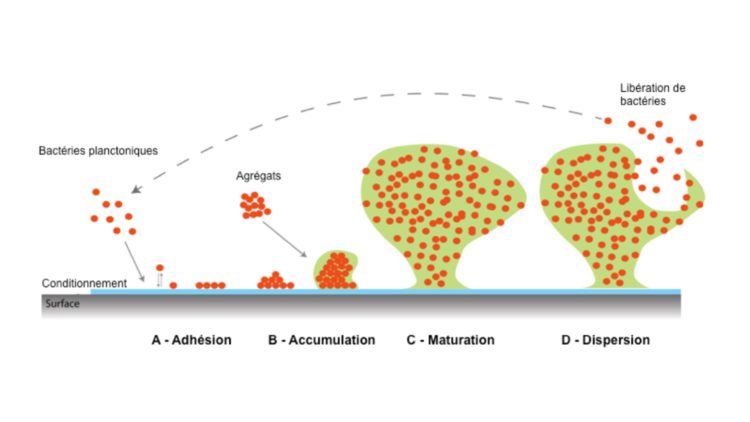
Figure 1 – Les quatre stades de développement du biofilm, représentés de gauche à droite.
La matrice d’EPS est présentée en vert, les bactéries en orange. A – Adhésion de bactéries planctoniques, d’abord de manière réversible, puis irréversible. B – Accumulation de biomasse pour former des microcolonies. C – Maturation du biofilm. La structure prend sa forme 3-D complexe et les hétérogénéités apparaissent au sein du biofilm. D – Dispersion, le biofilm relâche, de manière partiellement contrôlée, des bactéries dans l’environnement. Ces dernières peuvent recoloniser de nouvelles surfaces pour recommencer un cycle.
Les multiples rôles de la matrice d’EPS
La composition de la matrice d’EPS peut varier grandement en fonction des espèces qui composent le biofilm. Dans les biofilms de S. epidermidis, le polymère dominant est souvent le poly-N-acétylglucosamine (PNAG) 23 mais certaines souches incapables de produire le PNAG contrebalancent par une surexpression des protéines extracellulaires 24,25. Pour Pseudomonas aeruginosa, la matrice contient une majorité de polysaccharides de type alginate, les polymères Pel et Psl 26. L’ADN extracellulaire, aussi surnommé ADNe, est également un élément important de la matrice des biofilms, notamment chez Bacillus cereus 27. Les longues chaînes de nucléotides jouent un rôle de ciment du biofilm 28. L’interaction des divers EPS à travers divers types de forces (Van der Waals, électrostatique et ponts hydrogènes), apporte des propriétés cohésives qui maintiennent les bactéries au sein du biofilm, connectées les unes aux autres. Cette fonction est primordiale pour maintenir l’intégrité du biofilm et faire face à des forces extérieures qui pourraient compromettre la pérennité d’un biofilm sur la surface qu’il a colonisée 13.
Au-delà de ce simple rôle mécanique de cohésion, la matrice du biofilm représente un réservoir de nutriments et, de par sa nature hygroscopique, elle permet de conserver l’eau nécessaire à la croissance bactérienne 13. Les biofilms sont un mode de vie souvent adopté par les bactéries dans des situations stressantes comme une forme de protection. La capacité de la matrice du biofilm à adsorber et retenir les substances nutritives et l’eau permet aux bactéries dans un biofilm de continuer à croître lorsque les conditions sont moins favorables. La matrice joue également un rôle de barrière protectrice pour les bactéries du biofilm. En effet, les EPS forment un réseau dense de polymères qui limite fortement la pénétration des prédateurs (macrophages, protozoaires, virus) dans le biofilm et par conséquent protège les bactéries qui y résident 21. Enfin, elle favorise les mécanismes de communication entre les bactéries, un phénomène appelé quorum sensing. Ce système se base sur la détection de peptides signaux émis par les bactéries elles-mêmes pour reconnaître leurs pairs et réguler leur comportement en fonction de la densité de leur population 29. Dans le cas du biofilm, la population bactérienne est dense et la matrice piège les peptides signaux dans des espaces confinés. En conséquence, les seuils de ces molécules signal, par exemple des peptides cycliques ou des homosérines lactones, sont plus rapidement atteints. Par ce biais, les bactéries sont capables de coopérer et de s’organiser pour réagir face aux changements dans leur environnement 30.
Les biofilms et le transfert horizontal de gènes (THG)
La proximité des micro-organismes et la stabilité de l’environnement au sein des biofilms favorisent les échanges génétiques 31. A cet égard, les microorganismes commensaux (non pathogènes) et pathogènes peuvent s’échanger du contenu génétique par plusieurs moyens : l’échange direct de matériel génétique (conjugaison), l’absorption de matériel génétique externe (transformation) ou la modification de l’ADN par infection d’un virus (transduction).
Ces échanges génétiques deviennent critiques lorsqu’ils concernent les gènes de résistance aux antibiotiques (par exemple la résistance aux carbapénèmes 32 ou à la vancomycine 33) ou encore de gènes qui codent pour des facteurs de virulence. Dans ce cas, le biofilm devient un véritable forum d’échange dans lequel les bactéries augmentent leur potentiel de persistance et de pathogénicité.
Les biofilms dans le milieu médical
La préoccupation principale des hôpitaux en regard des biofilms est directement liée à leur implication dans diverses pathologies infectieuses. Depuis les travaux pionniers de William Costerton dans les années 1980, une littérature abondante documente la problématique des infections à biofilms 34–37. Plusieurs catégories sont fréquemment mentionnées. Dans la première catégorie, on retrouve les infections sur la partie du corps du patient ayant subi un acte de chirurgie invasive 38. Une contamination provenant de l’air, d’un contact avec une partie corporelle d’un membre du staff médical ou encore par un dispositif médical n’ayant pas subi une stérilisation ou désinfection adéquate. Ensuite, deux catégories d’infections causées par des biofilms sont intimement liées aux implants, il s’agit des infections sur les cathéters de veine centrale et sur les cathéters urinaires 39. La résistance des biofilms aux traitements antibiotiques complexifie le traitement des patients souffrant de telles affections 40. Il est fréquent de devoir procéder au retrait du dispositif infecté. De manière plus générale, tout matériel implanté est susceptible de servir de base pour le développement d’un biofilm si les conditions d’hygiène lors de l’opération ne sont pas optimales.
Les biofilms, une source d’infection nosocomiale ?
Si l’implication directe des biofilms dans de nombreux processus infectieux n’est plus à démontrer, leur impact indirect sur la transmission de germes pathogènes reste largement sous-estimé. L’environnement hospitalier n’échappe cependant pas à la colonisation par des biofilms bactériens qui représentent des réservoirs idéaux pour les micro-organismes. Ces réservoirs s’intègrent dans un cycle de contamination 41 qui inclut les patients, les agents causaux (micro-organismes) et des vecteurs tels que l’air, l’eau 42, le staff médical, les insectes 43, ou les dispositifs médicaux 44.
Plusieurs études rapportent la présence de biofilms sur des surfaces dans les hôpitaux. Une étude réalisée dans une unité de soins intensifs d’un hôpital australien a révélé la présence de souches de Staphylcoccus aureus résistant à la méthicilline (MRSA) et d’Entérocoques résistant à la vancomycine (VRE) sous la forme de biofilms après nettoyage. En particulier, les parois de seaux supposément stériles, le tissu de tenture ou encore la surface d’une porte en plastique ont été testées positives 45. Le cas d’Acinetobacter baumannii est également interpellant. En effet, de nombreuses sources rapportent que la fréquence des infections causées par cette espèce est en augmentation, probablement à cause de la persistance accrue de ce pathogène sur les surfaces inertes 46–48. Par ailleurs, A. baumannii est capable de se développer sous la forme de biofilms sur divers types de surfaces inertes (verre, acier inoxydable, et plusieurs types de plastiques). Les biofilms d’A. baumannii sont suspectés de jouer un rôle crucial dans l’acquisition d’infections (notamment urinaires et circulatoires) et l’apparition d’outbreaks au sein des établissement de soins 47,48.
Le réseau de distribution d’eau d’un hôpital représente également une source de contamination microbiologique non négligeable, le plus souvent avec des bactéries des genres Pseudomonas spp. et Legionella spp 49. En 2012, huit patients d’un hôpital du Wisconsin ont contracté la légionellose en une période de temps assez courte (15 jours) après leur passage dans l’hôpital. L’investigation environnementale menée pour détecter la source de la contamination a révélé que les surfaces d’une fontaine d’eau décorative étaient largement colonisées par des bactéries du genre Legionella jusqu’à des niveaux excédant les 100.000 CFU/échantillon de surface. Une analyse plus approfondie a confirmé la présence de biofilm sur plusieurs composants de la fontaine 50. Dans un autre hôpital en Irlande du Nord, la présence extensive de biofilms de P. aeruginosa a été identifiée sur la surface des robinets d’eau de distribution d’un département de pédiatrie néonatale. Ces biofilms représentent la source la plus probable de nombreux cas d’infections de nourrissons par P. aeruginosa, dont 4 ont été fatales 51. Ces deux exemples démontrent le rôle clé que joue le biofilm dans la persistance des bactéries pathogènes dans le réseau de distribution d’eau. En contact avec un biofilm, l’eau agit comme un vecteur important pour le transport et la transmission des germes vers le patient 42,52.
Les dispositifs médicaux peuvent, eux aussi, être sujets à la contamination par des biofilms. Les standards actuels de nettoyage et de désinfection de haut niveau peuvent, même lorsque les recommandations sont scrupuleusement suivies, ne pas parvenir à éliminer complètement les biofilms. Ces biofilms ancrés à la surface des dispositifs médicaux deviennent alors des vecteurs de dissémination de micro-organismes potentiellement pathogènes. Par exemple, les tubes endotrachéaux utilisés pour assister la respiration des patients ont été incriminés pour la transmission de pathogènes responsables de pneumonies sévères, dites associées au ventilateur. Dans une majorité des cas, les germes causatifs des pneumonies contractées par les patients ont été retrouvés en biofilm sur les parois des tubes 53,54. Une étude récente a démontré que les biofilms qui contaminent ces tubes sont multi-espèces, incluant des pathogènes reconnus comme P. aeruginosa, E. coli, K. pneumoniae mais également des espèces microbiennes dont la niche principale est la bouche. Ces dernières sont présumées ne pas jouer un rôle direct dans la pathogenèse mais agissent plutôt comme initiateurs de la formation d’un biofilm susceptible d’abriter les pathogènes susmentionnés 55.
Les biofilms sur les surfaces et les dispositifs médicaux non-implantables constituent d’importants réservoirs de pathogènes et pathogènes opportunistes, montrant une résilience accrue. Bien que le lien entre ces biofilms et les maladies nosocomiales soit moins bien documenté, une approche globale de prévention devrait inclure les biofilms comme un maillon de la dissémination et de la persistance des germes dans l’environnement hospitalier.
Le cas particulier des endoscopes dans la transmission de pathogènes de patients en patients
Parmi les dispositifs médicaux, les endoscopes attirent particulièrement l’attention de la communauté médicale et scientifique. Les « outbreaks » associés à l’utilisation d’endoscopes ne font plus figure d’exception, les cas d’infections qui ont pu être liés à l’utilisation d’endoscopes sont de plus en plus nombreux 56. Les Centers for Disease Control (CDC) aux USA indiquent, dans les recommandations de 2008, que les endoscopes sont responsables de plus d’« outbreaks » d’infections en milieu hospitalier que tous les autres dispositifs médicaux 57. Ce constat a été réitéré dans les « Multisociety guidelines on endoscope reprocessing » en 2016 58.
La formation de biofilms dans les lumens de ces instruments favorise grandement la persistance des pathogènes comme Klebsiella spp. et E. coli dans les gastroscopes, duodénoscopes et colonoscopes ainsi que de P. aeruginosa dans les bronchoscopes 59,60. Les standards de désinfection actuels pourraient se révéler insuffisants pour éliminer complètement les biofilms, laissant ainsi place à l’accumulation de biomasse bactérienne. Au cours des cycles d’utilisation et de nettoyage et désinfection, le biofilm présent dans les endoscopes se développe sous une forme appelée « Buildup Biofilm », connue pour exhiber une tolérance accrue à la chimie utilisée pour désinfecter les endoscopes. Dans une étude datant de 2009, le Dr. M. Alfa démontrait déjà l’abondance de cette forme incrustée de biofilm, résistante à la désinfection, qui s’accroît de cycle en cycle dans un modèle in vitro 61. La difficulté majeure rencontrée par les équipes responsables de la désinfection des endoscopes est le manque de moyen pour établir un diagnostic fiable de la propreté microbiologique des dispositifs prêts à l’emploi 56. En particulier, les méthodes actuelles de vérification de la contamination microbiologique des endoscopes ne sont pas adaptées pour mettre en évidence la présence de ce type de biofilms très incrustés et résistants tels que le « Buildup biofilm ». En effet, le prélèvement par solution stérile, actuellement considéré comme une des méthodes de référence 62, ne collecte qu’une partie du biofilm qui se décroche sous l’influence des forces de cisaillement de la solution stérile dans le lumen de l’endoscope. Ce protocole de référence actuel ne permet donc pas de mesurer l’état réel de contamination microbiologique des endoscopes mais a tendance à la sous-estimer.
Encore récemment, deux cas mortels d’infection par des entérobactéries résistantes aux carbapénèmes (ERC) ont été liés à l’utilisation de duodénoscopes dans deux hôpitaux de Los Angeles. Ces incidents confirment la nécessité de prendre en compte la complexité des formes de contamination microbienne dans les endoscopes et d’adapter les standards de nettoyage et de désinfection en fonction.
Quelles stratégies pour maîtriser la contamination par des biofilms ?
Lors de cette dernière décennie, la prise de conscience des risques associés à la présence de biofilm sur les surfaces hospitalières et sur les dispositifs médicaux a catalysé le développement de solutions adaptées à ce problème. La tendance principale, largement suivie, est d’insister sur une étape de nettoyage en profondeur avant d’appliquer des désinfectants, dont l’efficacité contre les biofilms est limitée 63,64. Dans certains cas, les formulations nettoyantes combinées à un désinfectant, par exemple à base d’acide peracétique, ont un effet indésirable en fixant le biofilm et la matière organique sur la surface à nettoyer 65. La fixation des contaminations sur des surfaces compromet l’efficacité du désinfectant en limitant son accès aux micro-organismes 66. De nombreuses études relatent le développement de molécules possédant un pouvoir désinfectant supérieur contre les bactéries en biofilm. En particulier, des améliorations significatives ont été réalisées au niveau de la pénétration des molécules biocides au cœur des biofilms, par exemple via leur encapsulation dans des nanoparticules 67. Ces dernières ont une charge neutre et un pouvoir de diffusion significativement plus élevé à travers le réseau de polymères de la matrice des biofilms bactériens. Des approches combinatoires, mêlant plusieurs principes actifs avec un effet anti-biofilm et/ou anti-bactérien ont également montré des résultats prometteurs 68.
Malgré l’amélioration des formules désinfectantes, il est communément admis qu’une étape de nettoyage efficace est le meilleur moyen de dégrader la matière organique incrustée et d’exposer les micro-organismes au désinfectant de manière optimale 69. Certaines formulations détergentes à base d’enzymes répondent à ce critère en s’attaquant aux composants de la matrice extracellulaire des biofilms, provoquant une dissolution massive des biofilms. Des résultats récents de OneLife montrent la valeur ajoutée des complexes multi-enzymatiques spécifiques pour assurer une élimination efficace des biofilms en comparaison avec d’autres détergents (enzymatiques ou non).
Sur des modèles de biofilms établis en laboratoire à partir de souches bactériennes pathogènes isolées aux Cliniques universitaires Saint-Luc (voir Tableau 1), la performance, en termes d’élimination des biofilms, de plusieurs détergents (voir Tableau 2) a été évaluées. Brièvement, les biofilms sont exposés durant 60 minutes à un détergent dosé selon les recommandations du fabricant dans une eau à 40°C sans agitation ni action mécanique. La biomasse résiduelle des biofilms est alors quantifiée par coloration et le pourcentage d’élimination du biofilm par rapport à un contrôle non-traité est établi. Ces résultats, publiés dans la revue Central Service en 2017, démontrent le spectre d’action large et l’efficacité supérieure du détergent multi-enzymatique de OneLife au regard de produits concurrents (voir Figure 1).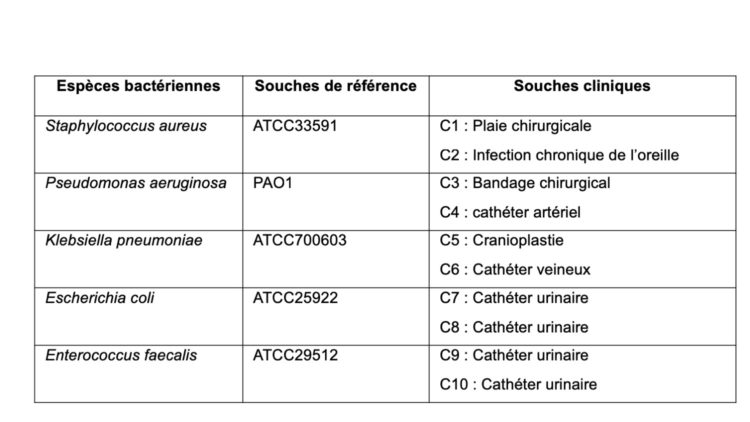
Tableau 1 – Souches employées pour constituer des biofilms en laboratoire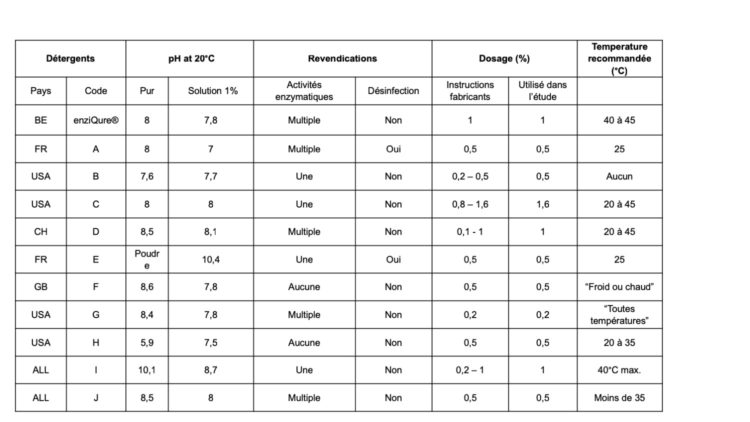
Tableau 2 – Description des différents détergents utilisés
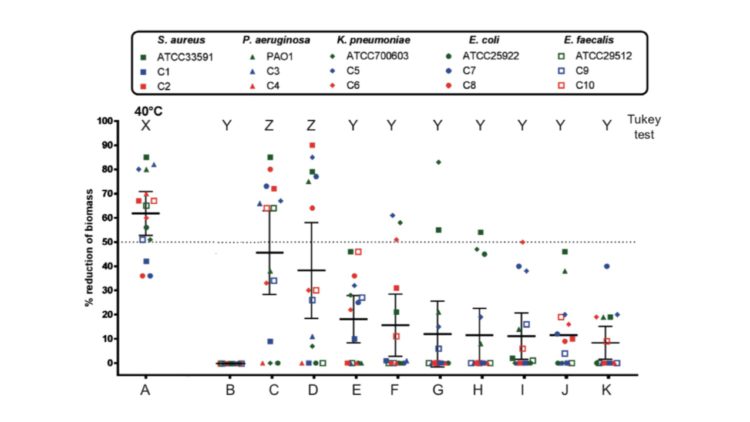
Figure 1 – Pourcentages d’élimination des biofilms constitués en laboratoire par les différents détergents
Chaque forme géométrique est associé à une espèce bactérienne et chaque couleur à un type d’isolat : vert = isolat de référence (laboratoire) ; bleu et rouge : isolats cliniques. Les barres horizontales représentent les moyennes globales pour les 15 souches par détergent avec les intervalles de confiance à 95%.
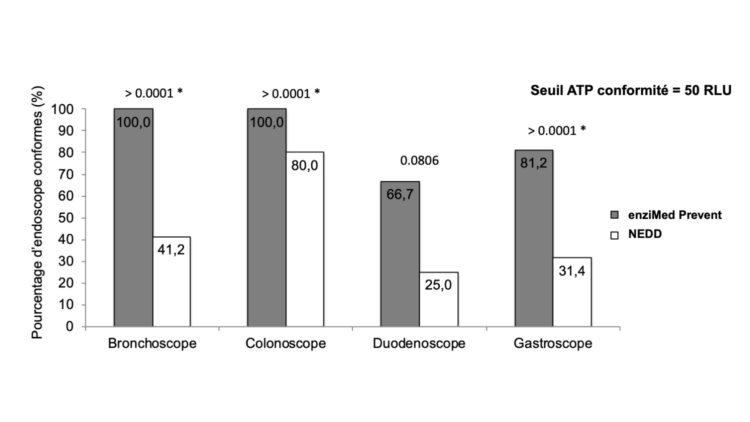
Les détergents OneLife ont également été testés en conditions réelles pour le nettoyage manuel des endoscopes flexibles au CHU de Liège. L’enziMed® Prevent, détergent destiné au nettoyage quotidien et en routine des endoscopes après chaque procédure, a été comparé à un détergent concurrent (non-enzymatique, pré-désinfectant) au moyen d’une analyse de propreté avant/après nettoyage manuel des endoscopes à l’aide de la technique de l’ATP (mesure du niveau de souillure global). Les résultats qui seront publiés dans les semaines à venir, révèlent que l’utilisation de l’enziMed® Prevent apporte une plus-value à l’efficacité du nettoyage manuel, permettant d’arriver à un niveau de propreté supérieur avant l’étape de désinfection chimique des appareils à l’acide peracétique (voir Figure 2). Il est maintenant communément admis que la désinfection chimique ne peut être efficace à 100% que si elle est réalisée sur un dispositif médical propre. Tout résidu de souillure peut interférer avec la désinfection chimique et poser le risque de la présence microbiologique dans l’endoscope après désinfection.
Figure 2 – Pourcentage d’endoscopes présentant un niveau de propreté satisfaisante (seuil de 50 RLU) après nettoyage manuel avec l’enziMed Prevent ou le détergent concurrent en fonction du type d’appareil. Les p-valeurs des tests de Chi-carré de comparaison sont indiqués au-dessus des histogrammes.
L’enziQure®, un détergent à vocation curative, a lui aussi été testé dans plusieurs dizaines de centres hospitaliers en Belgique et en France ayant identifié une contamination microbiologique persistante au sein d’un ou plusieurs de leurs endoscopes. Au moyen d’un protocole de nettoyage renforcé incluant l’enziQure® (60 min de trempage avec 3 étapes de brossage) suivi d’une désinfection habituelle en auto-laveur, plus de 90% des endoscopes traités ont pu être ramenés à un niveau de propreté microbiologique satisfaisante (selon les recommandations de qualité françaises de 2017).
Conclusions
Les biofilms bactériens sont le résultat de l’évolution qui tend à favoriser les modes de vies résilients, résistants à de fortes pressions de l’environnement. Les biofilms représentent 90% du mode de vie bactérien dans la nature et colonisent l’environnement hospitalier, sur des surfaces inertes, dans le réseau d’eau et sur les dispositifs médicaux. Leur présence permet à des germes, parfois pathogènes, de résider durant de très longues périodes, allant jusqu’à plusieurs mois, sur des surfaces, formant ainsi des réservoirs. Ces derniers constituent des environnements favorables pour le transfert de gènes notamment de résistance aux antibiotiques.
L’importance du rôle des biofilms comme cause d’infections nosocomiales sur les dispositifs médicaux implantés a été clairement établi. Cependant, leur impact en tant que réservoir de germes pathogènes en hôpital, sur les surfaces inertes et dispositifs médicaux non-implantables, commence seulement à être réellement investigué. Les nombreux cas d’outbreaks aux ERC, Legionella ou Pseudomonas rapportés récemment indiquent que les biofilms peuvent être une source importante de contamination des patients. Par conséquent, il est crucial de s’attaquer aux biofilms bactériens pour réduire la persistance des pathogènes en milieu hospitalier. De par leur nature fondamentalement différente des bactéries planctoniques, les stratégies de lutte contre les biofilms doivent atteindre l’intégrité du biofilm, notamment sa matrice d’EPS.
Remerciements
Les auteurs tiennent à remercier l’équipe d’hygiène hospitalière et de gastroentérologie du CHU de Liège ainsi que le Prof. Françoise Van Bambeke et le Dr. Wafi Siala du laboratoire de pharmacologie moléculaire et cellulaire du Louvain Drug Research Institute à l’UCL pour avoir contribué aux données qui sont présentées dans cet article.
Références
1 The Lancet Gastroenterology Hepatology TLG&. Scoping the problem: endoscopy-associated infections. Lancet Gastroenterol Hepatol 2018;3(7):445. Doi: 10.1016/S2468-1253(18)30168-7.
2 Jimeno A., Alcalde MM., Ortiz M., Rodríguez A., Alcaraz B., Vera F. Outbreak of urinary tract infections by Salmonella spp. after cystoscopic manipulation. Actas Urológicas Españolas 2016;40(10):646–9. Doi: 10.1016/j.acuro.2016.02.005.
3 Kola A., Piening B., Pape U-F., et al. An outbreak of carbapenem-resistant OXA-48 – producing Klebsiella pneumonia associated to duodenoscopy. Antimicrob Resist Infect Control 2015;4(1):8. Doi: 10.1186/s13756-015-0049-4.
4 Bancroft EA., English L., Terashita D., Yasuda L. Outbreak of Escherichia coli infections associated with a contaminated transesophageal echocardiography probe. Infect Control Hosp Epidemiol 2013;34(10):1121–3. Doi: 10.1086/673160.
5 Costerton JW., Lewandowski Z., Caldwell DE., Korber DR., Lappin-scott HM. Microbial biofilms. Annu Rev Microbiol 1995;49:711–45.
6 Monds RD., O’Toole GA. The developmental model of microbial biofilms: ten years of a paradigm up for review. Trends Microbiol 2009;17(2):73–87. Doi: 10.1016/j.tim.2008.11.001.
7 Hartford O., O’Brien L., Schofield K., Wells J., Foster TJ. The Fbe (SdrG) protein of Staphylococcus epidermidis HB promotes bacterial adherence to fibrinogen. Microbiology 2001;147(9):2545–52.
8 Herman P., El-Kirat-Chatel S., Beaussart A., Geoghegan JA., Foster TJ., Dufrêne YF. The binding force of the staphylococcal adhesin SdrG is remarkably strong. Mol Microbiol 2014;93(2):356–68. Doi: 10.1111/mmi.12663.
9 Vanzieleghem T., Herman-Bausier P., Dufrene YF., Mahillon J. Staphylococcus epidermidis Affinity for Fibrinogen-Coated Surfaces Correlates with the Abundance of the SdrG Adhesin on the Cell Surface. Langmuir 2015:150413154944000. Doi: 10.1021/acs.langmuir.5b00360.
10 Tang H., Cao T., Liang X., et al. Influence of silicone surface roughness and hydrophobicity on adhesion and colonization of Staphylococcus epidermidis. J Biomed Mater Res A 2009;88(2):454–63. Doi: 10.1002/jbm.a.31788.
11 Katainen J., Paajanen M., Ahtola E., Pore V., Lahtinen J. Adhesion as an interplay between particle size and surface roughness. J Colloid Interface Sci 2006;304(2):524–9. Doi: 10.1016/j.jcis.2006.09.015.
12 Busscher HJ., van der Mei HC. How do bacteria know they are on a surface and regulate their response to an adhering state? PLoS Pathog 2012;8(1):e1002440. Doi: 10.1371/journal.ppat.1002440.
13 Flemming H-C., Wingender J. The biofilm matrix. Nat Rev Microbiol 2010;8(9):623–33. Doi: 10.1038/nrmicro2415.
14 Davenport EK., Call DR., Beyenal H. Differential protection from tobramycin by extracellular polymeric substances from Acinetobacter baumannii and Staphylococcus aureus biofilms. Antimicrob Agents Chemother 2014;58(8):4755–61. Doi: 10.1128/AAC.03071-14.
15 Schwering M., Song J., Louie M., Turner RJ., Ceri H. Multi-species biofilms defined from drinking water microorganisms provide increased protection against chlorine disinfection. Biofouling 2013;29(8):917–28. Doi: 10.1080/08927014.2013.816298.
16 Stewart PS., Franklin MJ. Physiological heterogeneity in biofilms. Nat Rev Microbiol 2008;6(3):199–210. Doi: 10.1038/nrmicro1838.
17 Beyenal H., Lewandowski Z. Modeling mass transport and microbial activity in stratified biofilms. Chem Eng Sci 2005;60(15):4337–48. Doi: 10.1016/j.ces.2005.02.063.
18 Bester E., Kroukamp O., Wolfaardt GM., Boonzaaier L., Liss SN. Metabolic differentiation in biofilms as indicated by carbon dioxide production rates. Appl Environ Microbiol 2010;76(4):1189–97. Doi: 10.1128/AEM.01719-09.
19 Kaplan JB. Biofilm dispersal: mechanisms, clinical implications, and potential therapeutic uses. J Dent Res 2010;89(3):205–18. Doi: 10.1177/0022034509359403.
20 McDougald D., Rice SA., Barraud N., Steinberg PD., Kjelleberg S. Should we stay or should we go: mechanisms and ecological consequences for biofilm dispersal. Nat Rev Microbiol 2012;10(1):39–50. Doi: 10.1038/nrmicro2695.
21 Jefferson KK. What drives bacteria to produce a biofilm? FEMS Microbiol Lett 2004;236(2):163–73. Doi: 10.1016/j.femsle.2004.06.005.
22 Hall-Stoodley L., Stoodley P. Biofilm formation and dispersal and the transmission of human pathogens. Trends Microbiol 2005;13(1):7–10. Doi: 10.1016/j.tim.2004.11.004.
23 Otto M. Staphylococcus epidermidis–the “accidental” pathogen. Nat Rev Microbiol 2009;7(8):555–67. Doi: 10.1038/nrmicro2182.
24 Christner M., Franke GC., Schommer NN., et al. The giant extracellular matrix-binding protein of Staphylococcus epidermidis mediates biofilm accumulation and attachment to fibronectin. Mol Microbiol 2010;75(1):187–207. Doi: 10.1111/j.1365-2958.2009.06981.x.
25 Valle J., Latasa C., Gil C., et al. Bap, a biofilm matrix protein of Staphylococcus aureus prevents cellular internalization through binding to GP96 host receptor. PLoS Pathog 2012;8(8):e1002843. Doi: 10.1371/journal.ppat.1002843.
26 Franklin MJ., Nivens DE., Weadge JT., Howell PL. Biosynthesis of the Pseudomonas aeruginosa Extracellular Polysaccharides, Alginate, Pel, and Psl. Front Microbiol 2011;2(August):167. Doi: 10.3389/fmicb.2011.00167.
27 Vilain S., Pretorius JM., Theron J., Brözel VS. DNA as an adhesin: Bacillus cereus requires extracellular DNA to form biofilms. Appl Environ Microbiol 2009;75(9):2861–8. Doi: 10.1128/AEM.01317-08.
28 Jakubovics NS., Shields RC., Rajarajan N., Burgess JG. Life after death: the critical role of extracellular DNA in microbial biofilms. Lett Appl Microbiol 2013;57(6):467–75. Doi: 10.1111/lam.12134.
29 Atkinson S., Williams P. Quorum sensing and social networking in the microbial world. J R Soc Interface 2009;6(40):959–78. Doi: 10.1098/rsif.2009.0203.
30 Dickschat JS. Quorum sensing and bacterial biofilms. Nat Prod Rep 2010;27(3):343–69. Doi: 10.1039/b804469b.
31 Molin S., Tolker-Nielsen T. Gene transfer occurs with enhanced efficiency in biofilms and induces enhanced stabilisation of the biofilm structure. Curr Opin Biotechnol 2003;14(3):255–61. Doi: 10.1016/S0958-1669(03)00036-3.
32 Goren MG., Carmeli Y., Schwaber MJ., Chmelnitsky I., Schechner V., Navon-Venezia S. Transfer of carbapenem-resistant plasmid from Klebsiella pneumoniae ST258 to Escherichia coli in patient. Emerg Infect Dis 2010;16(6):1014–7. Doi: 10.3201/eid1606.091671.
33 de Niederhäusern S., Bondi M., Messi P., et al. Vancomycin-resistance transferability from VanA enterococci to Staphylococcus aureus. Curr Microbiol 2011;62(5):1363–7. Doi: 10.1007/s00284-011-9868-6.
34 Dunny GM., Hancock LE., Shankar N. Enterococcal Biofilm Structure and Role in Colonization and Disease 2014.
35 Mombelli A., Décaillet F. The characteristics of biofilms in peri-implant disease. J Clin Periodontol 2011;38:203–13. Doi: 10.1111/j.1600-051X.2010.01666.x.
36 Wolcott R., Costerton JW., Raoult D., Cutler SJ. The polymicrobial nature of biofilm infection. Clin Microbiol Infect 2013;19(2):107–12. Doi: 10.1111/j.1469-0691.2012.04001.x.
37 Harriott MM., Noverr MC. Importance of Candida-bacterial polymicrobial biofilms in disease. Trends Microbiol 2011;19(11):557–63. Doi: 10.1016/j.tim.2011.07.004.
38 Kathju S., Nistico L., Hall-Stoodley L., Post JC., Ehrlich GD., Stoodley P. Chronic surgical site infection due to suture-associated polymicrobial biofilm. Surg Infect (Larchmt) 2009;10(5):457–61. Doi: 10.1089/sur.2008.062.
39 Trautner BW., Darouiche RO. Role of biofilm in catheter-associated urinary tract infection. Am J Infect Control 2004;32(3):177–83. Doi: 10.1016/j.ajic.2003.08.005.
40 Costerton JW., Montanaro L., Arciola CR. Biofilm in implant infections: its production and regulation. Int J Artif Organs 2005;28(11):1062–8.
41 Otter JA., Yezli S., Salkeld JAG., French GL. Evidence that contaminated surfaces contribute to the transmission of hospital pathogens and an overview of strategies to address contaminated surfaces in hospital settings. Am J Infect Control 2013;41(5):S6–11. Doi: 10.1016/j.ajic.2012.12.004.
42 Wingender J., Flemming H-C. Biofilms in drinking water and their role as reservoir for pathogens. Int J Hyg Environ Health 2011;214(6):417–23. Doi: 10.1016/j.ijheh.2011.05.009.
43 Graczyk TK., Knight R., Gilman RH., Cranfield MR. The role of non-biting flies in the epidemiology of human infectious diseases. Microbes Infect 2001;3(3):231–5. Doi: 10.1016/S1286-4579(01)01371-5.
44 Roberts CG. The role of biofilms in reprocessing medical devices. Am J Infect Control 2013;41(5 Suppl):S77-80. Doi: 10.1016/j.ajic.2012.12.008.
45 Vickery K., Deva a., Jacombs a., Allan J., Valente P., Gosbell IB. Presence of biofilm containing viable multiresistant organisms despite terminal cleaning on clinical surfaces in an intensive care unit. J Hosp Infect 2012;80(1):52–5. Doi: 10.1016/j.jhin.2011.07.007.
46 Roca I., Espinal P., Vila-Farrés X., Vila J. The Acinetobacter baumannii Oxymoron: Commensal Hospital Dweller Turned Pan-Drug-Resistant Menace. Front Microbiol 2012;3:148. Doi: 10.3389/fmicb.2012.00148.
47 Joshi SG. Acinetobacter baumannii : An emerging pathogenic threat to public health. World J Clin Infect Dis 2013;3(3):25. Doi: 10.5495/wjcid.v3.i3.25.
48 Longo F., Vuotto C., Donelli G. Biofilm formation in Acinetobacter baumannii. New Microbiol 2014;37:119–27.
49 Mulcahy LR., Isabella VM., Lewis K. Pseudomonas aeruginosa biofilms in disease. Microb Ecol 2014;68(1):1–12. Doi: 10.1007/s00248-013-0297-x.
50 Haupt TE., Heffernan RT., Kazmierczak JJ., et al. An Outbreak of Legionnaires Disease Associated with a Decorative Water Wall Fountain in a Hospital. Infect Control Hosp Epidemiol 2012;33:185–91. Doi: 10.1086/663711.
51 Walker JT., Jhutty A., Parks S., et al. Investigation of healthcare-acquired infections associated with Pseudomonas aeruginosa biofilms in taps in neonatal units in Northern Ireland. J Hosp Infect 2014;86(1):16–23. Doi: 10.1016/j.jhin.2013.10.003.
52 Falkinham JO., Hilborn ED., Arduino MJ., Pruden A., Edwards MA. Epidemiology and Ecology of Opportunistic Premise Plumbing Pathogens: Legionella pneumophila, Mycobacterium avium, and Pseudomonas aeruginosa. vol. In Press. 2015.
53 De Souza PR., De Andrade D., Cabral DB., Watanabe E. Endotracheal tube biofilm and ventilator-associated pneumonia with mechanical ventilation. Microsc Res Tech 2014;77(4):305–12. Doi: 10.1002/jemt.22344.
54 Gil-Perotin S., Ramirez P., Marti V., et al. Implications of endotracheal tube biofilm in ventilator-associated pneumonia response: a state of concept. Crit Care 2012;16(3):R93. Doi: 10.1186/cc11357.
55 Vandecandelaere I., Coenye T. Microbial composition and antibiotic resistance of biofilms recovered from endotracheal tubes of mechanically ventilated patients. Adv Exp Med Biol 2015;830:137–55. Doi: 10.1007/978-3-319-11038-7_9.
56 Kovaleva J., Peters FTM., van der Mei HC., Degener JE. Transmission of infection by flexible gastrointestinal endoscopy and bronchoscopy. Clin Microbiol Rev 2013;26(2):231–54. Doi: 10.1128/CMR.00085-12.
57 Rutala WA., Weber DJ., HICPAC. CDC Guidelines for Disinfection and Sterilization in Healthcare Facilities 2008:1–27.
58 Petersen BT., Cohen J., Hambrick RD., et al. Multisociety guideline on reprocessing flexible GI endoscopes: 2016 update. Gastrointest Endosc 2017;85(2):282–94. Doi: 10.1016/j.gie.2016.10.002.
59 Muscarella LF. Risk of transmission of carbapenem-resistant Enterobacteriaceae and related “superbugs” during gastrointestinal endoscopy. World J Gastrointest Endosc 2014;6(10):457–74. Doi: 10.4253/wjge.v6.i10.457.
60 Kovaleva J., Peters FTM., van der Mei HC., Degener JE. Transmission of infection by flexible gastrointestinal endoscopy and bronchoscopy. Clin Microbiol Rev 2013;26(2):231–54. Doi: 10.1128/CMR.00085-12.
61 Alfa MJ., Howie R. Modeling microbial survival in buildup biofilm for complex medical devices. BMC Infect Dis 2009;9:56. Doi: 10.1186/1471-2334-9-56.
62 Ministère de la santé et des solidarités DGS/DHOS C. Elements D’Assurance Qualite En Hygiene Relatifs Au Contrôle Microbiologique des Endoscopes et à la Tracabilite en Endoscopie 2007:1–55.
63 Abreu AC., Tavares RR., Borges A., Mergulhão F., Simões M. Current and emergent strategies for disinfection of hospital environments. J Antimicrob Chemother 2013;68(July):2718–32. Doi: 10.1093/jac/dkt281.
64 Dancer SJ. The role of environmental cleaning in the control of hospital-acquired infection. J Hosp Infect 2009;73(4):378–85. Doi: 10.1016/j.jhin.2009.03.030.
65 Kampf G., Fliss PM., Martiny H. Is peracetic acid suitable for the cleaning step of reprocessing flexible endoscopes? World J Gastrointest Endosc 2014;6(9):390–406. Doi: 10.4253/wjge.v6.i9.390.
66 Knieler R. Manual cleaning and disinfection of flexible endoscopes–an approach to evaluating a combined procedure. J Hosp Infect 2001;48 Suppl A:S84-7.
67 Forier K., Raemdonck K., De Smedt SC., Demeester J., Coenye T., Braeckmans K. Lipid and polymer nanoparticles for drug delivery to bacterial biofilms. J Control Release 2014;190:607–23. Doi: 10.1016/j.jconrel.2014.03.055.
68 Varposhti M., Abdi Ali A., Mohammadi P. Synergistic Effects of Bismuth Thiols and Various Antibiotics Against Pseudomonas aeruginosa Biofilm. Jundishapur J Microbiol 2014;7(3):e9142. Doi: 10.5812/jjm.9142.
69 Martiny H., Floss H., Zühlsdorf B. The importance of cleaning for the overall results of processing endoscopes. J Hosp Infect 2004;56 Suppl 2:S16-22. Doi: 10.1016/j.jhin.2003.12.027.
70 L’auteur Thomas Van Vanzieleghem travaille également chez OneLife S.A., Avenue Albert Einstein 15, 1348 Louvain-la-Neuve
Nouveautés
Agenda scientifique
- mars 2024
-
28/03
Symposium BICS
- avril 2024
-
du 8/04 au 11/04 || à Edinburgh
The Microbiology Society Annual Conference
-
du 23/04 au 24/04 || à Birmingham
Prévention et Contrôle des infections (IPC)
-
du 27/04 au 30/04 || à Barcelone
34th European Congress of Clinical Microbiology and infectious diseases
- mai 2024
-
du 16/05 au 17/05 || à Louvain-La-Neuve
18ème Rencontre Internationale Francophone des Infirmiers et Infirmières (RIF)


