Entérobactéries productrices de carbapénémases importées: le contexte belge

L’accroissement de la mobilité des populations contribue à l’augmentation du risque d’importation et de dissémination d’entérobactéries productrices de carbapénémases (CPE) dans les institutions de soins en Belgique par le biais de personnes ayant voyagé à l’étranger avec ou sans hospitalisation pendant leur séjour.
1-Aperçu de la problématique
Depuis le début de la surveillance épidémiologique des CPE en Belgique en janvier 2012, seulement 12% des cas de CPE recensés étaient liés à un séjour à l’étranger (66 cas sur 566). La pratique du dépistage limitée à ce seul groupe à risque ne suffit donc plus pour prévenir la dissémination de CPE dans notre pays.
Il est cependant nécessaire de rester vigilant vis-à-vis de ce groupe à risque ainsi que l’indiquent les résultats de l’étude récente VOYAG-R(1). Entre février 2012 et mars 2013, les auteurs de cette étude ont examiné le risque d’acquisition de CPE et d’entérobactéries productrices de beta-lactamases à spectre étendu (EBLSE) auprès de 574 voyageurs au retour d’un voyage à l’étranger (Amérique: n=183 voyageurs; Afrique: n=195, Moyen-Orient et Asie du Sud-est: n=196 dont 57 ayant séjourné en Inde). Les voyageurs qui avaient visité ces continents présentaient un risque accru d’acquisition de CPE après une hospitalisation pendant le séjour, lors d’un rapatriement sanitaire, voire même lorsque ils n’avaient eu aucun contact direct avec un secteur de soins de santé dans ces régions.
Une CPE a été identifiée chez 3 touristes sur 57 (5%) au retour en France d’un voyage en Inde (deux E. coli OXA-181[1] et un E. coli New-Delhi producteur de métallo-béta-lactamase 1 (NDM-1). Aucun d’entre eux n’avait été en contact avec des institutions de soins pendant leur séjour en Inde. Des cultures de suivi réalisées chez ces trois personnes après leur retour en France ont permis de montrer que la durée du portage intestinal de CPE était relativement courte (3 mois au maximum).
Il est probable que les mauvaises conditions d’hygiène et sanitaires (contamination de l’environnement, des aliments et de l’eau) et l’usage incontrôlé d’antibiotiques en Inde constituent des facteurs de risque d’acquisition de CPE et de EBLSE lors d’un voyage dans ce pays, même si aucun de ces trois voyageurs n’avait reçu des antibiotiques pendant leur séjour.
[1] OXA-181 : mutant d’OXA-48 typiquement retrouvée dans les isolats de CPE issus du sous-continent indien. OXA-181 est très souvent présent en association avec la carbapénémase NDM (ou plus rarement VIM).
Pour les EBLSE, un lien avec des voyages à l’étranger(2-6) avait déjà été bien établi depuis plus longtemps. Selon les études, le pourcentage de portage d’EBLSE acquis chez des voyageurs varie de 5 à 85%, selon les pays visités (3-6). Une étude effectuée en Suède entre 2008 et 2009(4,5) montrait que l’acquisition d’ESBLE était fréquente (30% des voyageurs) lors de voyages internationaux et que le facteur de risque de colonisation par ESBLE le plus important était le continent visité. Le risque plus élevé était associé à un voyage dans le sous-continent Indien, une colonisation était retrouvée chez 71.4% des voyageurs de ce continent (OR (odd’s ratio) 24.8, p<0.001), suivi de l’Asie à l’exclusion de l’Inde (44.8%, OR 8.63, p<0.001) et de l’Afrique du Nord (43.3%, OR 4.94, p=0.002).
Ces observations coïncident globalement avec les résultats d’autres études similaires réalisées antérieurement(3), (4),( 6),(7),(8),(9).
Les autres facteurs de risque d’acquisition d’EBLSE liés au voyage étaient la survenue de diarrhée ou d’autres symptômes digestifs pendant le séjour et l’âge du voyageur (les patients âgés de plus de 65 ans présentaient le risque d’acquisition le plus élevé). Dans l’étude suédoise aucune acquisition de CPE n’a pu être mise en évidence, mais la méthode utilisée pour le dépistage ciblait surtout la détection d’entérobactéries résistantes aux céphalosporines. Il est dès lors probable que la présence éventuelle de carbapénémases (en particulier de type OXA-48) ait pu être sous-estimée.
Selon la littérature, la durée de portage d’EBLSE peut être longue, 18% des voyageurs étant encore porteurs asymptomatiques 6 mois après l’acquisition(6).
L’importation de CPE et d’autres MDRO (multidrug resistant organisms) après un voyage peut non seulement être à l’origine d’épidémies, mais peut également être la source d’infections sévères potentiellement létales(10).
2-Résultats de surveillance: les patients porteurs de CPE liée à l’étranger dans les établissements de soins en Belgique
Depuis le début de la surveillance active des CPE (janvier 2012) en Belgique, 890 patients colonisés ou infectés par CPE ont été rapportés sur une période de 24 mois. La notion d’un séjour à l’étranger avec ou sans hospitalisation était présente chez 66 patients sur 566 (12%) porteurs de CPE pour lesquels ces informations étaient disponibles (données manquantes pour 324 patients (36%)).
Sur les 86 laboratoires ayant participé à la surveillance, 23 laboratoires hospitaliers et un laboratoire privé ont rapporté au moins un cas de patient avec CPE associé au voyage. Au cours du second semestre de chaque année, le nombre de cas associés au voyage était plus élevé (doublé) qu’en début de l’année, sans doute en partie sous l’influence du tourisme estival (Figure 1).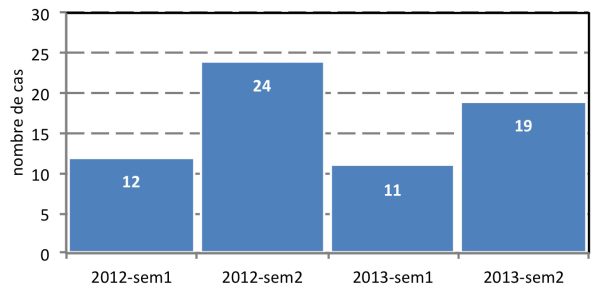
Figure 1: Nombre semestriel de cas de CPE associé au voyage en Belgique (n=66): 2012 – 2013
La plupart des cas importés ont été recensés par 6 des 7 hôpitaux universitaires (62%, 41/66 cas), tandis que les hôpitaux généraux n’ont rapporté que 36% des cas (24/66). Il est probable que cette différence s’explique par le fait que les hôpitaux universitaires accueillent plus fréquemment des patients rapatriés à partir de pays étrangers.
La moitié de cas de CPE d’importation a été rapportée en région bruxelloise: au total 33 cas, dont 26 par 3 hôpitaux universitaires bruxellois (Figure 2).
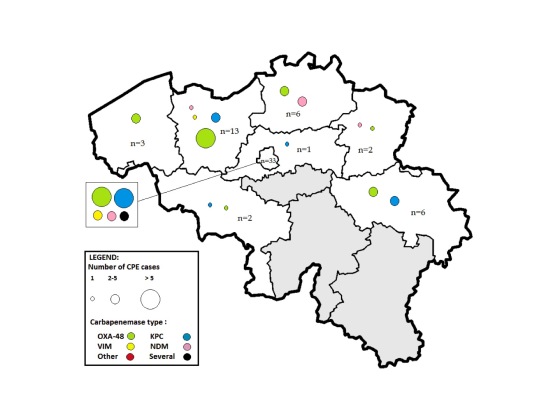
Figure 2: Répartition géographique des cas de CPE associés au voyage rapportés en Belgique et distribution des différents types de carbapénémases, 2012-2013
Le pays de séjour/d’hospitalisation était connu pour 65 patients porteurs de CPE associé au voyage. Vingt-neuf cas (45%) étaient liés à un séjour en Afrique, 18 (28%) à un séjour en Asie et 18 (28%) à un pays européen.
Afrique (n= 29)
Les pays d’Afrique du Nord (Maroc, Algérie, Tunisie, Libye, Égypte et le Sénégal) étaient le plus souvent impliqués. 25 cas de CPE sur 29 importés à partir de l’Afrique étaient producteurs d’une carbapénémase de type OXA-48 (Figure 3).
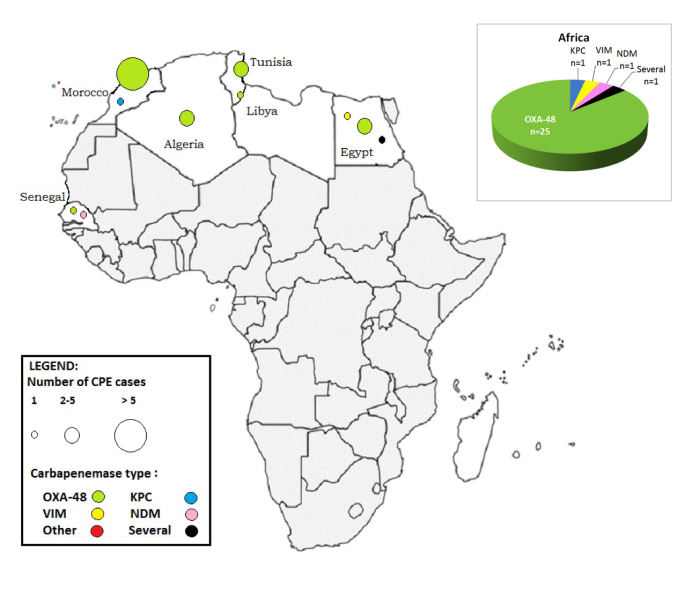
Figure 3: CPE associées à un séjour/une hospitalisation dans un pays Africain: nombre de cas et types de carbapénémases par pays déclarés en Belgique, 2012-2013
Asie (n= 18)
Deux types de carbapénémases importées à partir de pays asiatiques étaient rencontrées (Figure 4): OXA-48 (surtout en Turquie, n= 10) et NDM (Inde, Pakistan et Vietnam: n= 6).
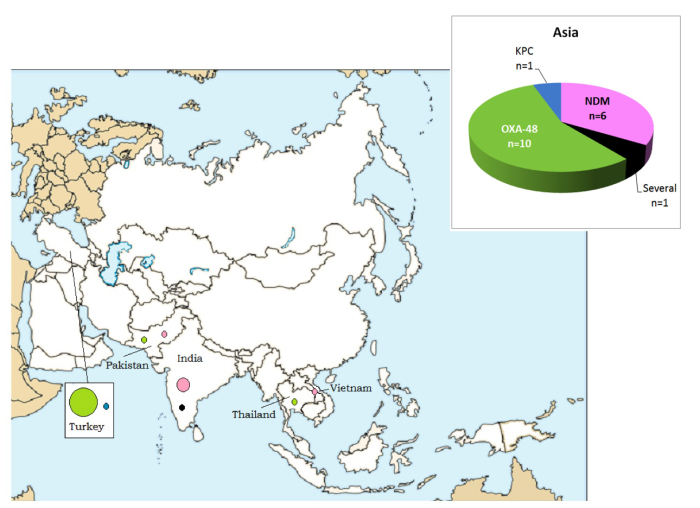
Figure 4: CPE associées à un séjour/une hospitalisation dans un pays Asiatique: nombre de cas et types de carbapénémases par pays déclarés en Belgique, 2012-2013
Europe (n= 18)
Les cas de CPE associés à un récent séjour/ hospitalisation dans un pays européen (Figure 5) impliquaient surtout des carbapénémases de type KPC (Grèce et Italie, n=10) et de type OXA-48 (Grèce, n=4).
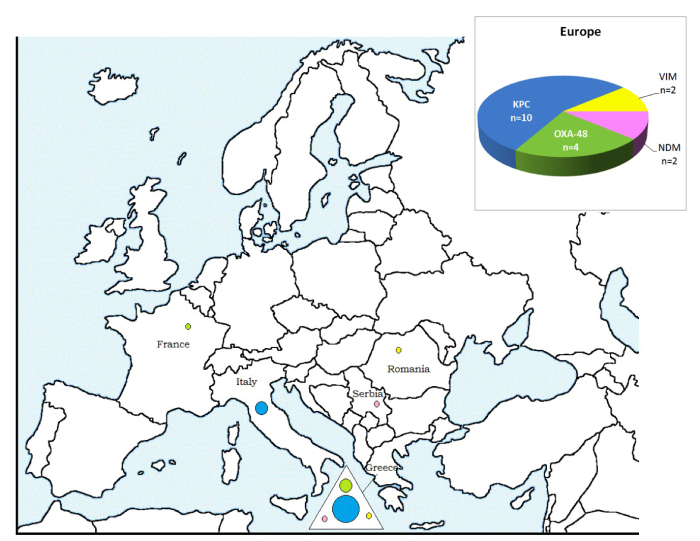
Figure 5: CPE associées à un séjour/une hospitalisation dans un pays européen: nombre de cas et types de carbapénémases par pays déclarés en Belgique, 2012-2013
3-Considérations relatives à l’importation de CPE et de MDRO en Belgique
3.1. CPE chez les voyageurs, un groupe à risque d’importance sous-estimée
Bien que la proportion de cas de CPE (colonisation ou infection) recensée au décours d’un séjour à l’étranger ne représente que 12% de l’ensemble des cas rapportés en Belgique, il y a lieu de rester vigilant vis-à-vis de ce groupe à risque particulier dont l’importance est sans doute largement sous-estimée puisque dans plus d’un tiers des cas de CPE déclarés en Belgique, aucune information n’était disponible quant à la notion de voyage ou d’hospitalisation à l’étranger. Ce manque d’exhaustivité est vraisemblablement inhérent à la nature de la surveillance le plus souvent initiée à partir du laboratoire de microbiologie et plus rarement par les acteurs de terrain (équipe d’hygiène hospitalière, équipes médicales et paramédicales dans les unités d’hospitalisation). Idéalement ces informations devraient être obtenues directement auprès des patients ou de leur entourage proche. Une anamnèse détaillée de voyage incluant toute notion de contact avec une structure de soins de santé dans un pays à l’étranger est cruciale mais se révèle en pratique extrêmement difficile à réaliser ou à obtenir.
3.2. Vu la globalisation des CPE, l’utilisation d’une liste de pays endémiques/épidémiques n’est plus utile
Dans son avis du 7 décembre 2011[1], le Conseil Supérieur de la Santé recommandait de dépister le portage de CPE chez tout patient transféré d’un hôpital dans un des pays en situation épidémique ou endémique pour les CPE. S’il était peut-être pertinent de tenter de dresser un tableau des pays à endémicité élevée pour CPE en 2011, cette notion apparaît aujourd’hui dépassée dans un contexte de globalisation rapide de l’épidémiologie des CPE. Aussi, il faut actuellement considérer que tout patient transféré d’un hôpital à l’étranger présente un risque accru de colonisation/infection par CPE. Par ailleurs, les études précitées montraient que des voyageurs sains qui avaient séjourné dans certaines contrées endémiques telles le sous-continent Indien, pouvaient être colonisés par des EBLSE et/ou CPE même en l’absence de tout contact préalable avec un secteur de soins de santé ou sans exposition directe à des traitements antibiotiques.
3.3. Les sources potentielles d’importation de CPE associées à l’étranger sont diverses
3.3.1. L’accroissement de la mobilité de la population et du tourisme mondial
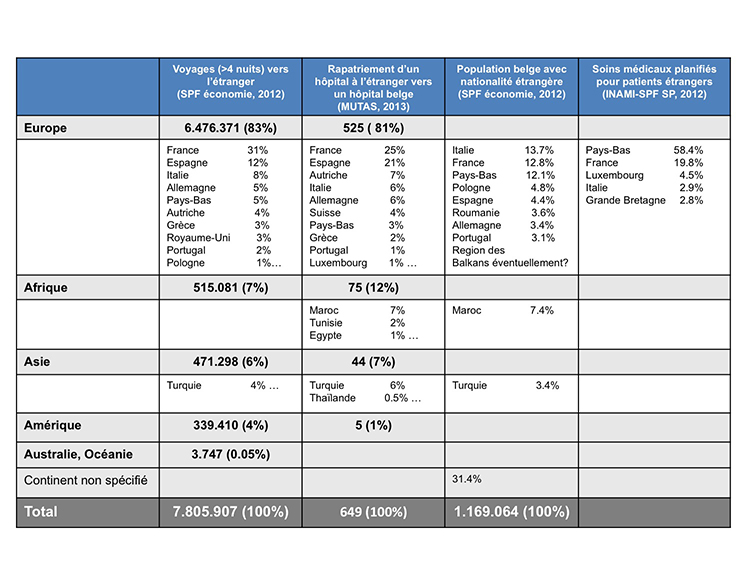
La grande mobilité des populations contribue largement à la mobilité des bactéries résistantes et à la globalisation des MDRO dans le monde(11). En raison de sa situation centrale en Europe, la Belgique constitue un lieu de passage important tant pour l’industrie du tourisme que pour les activités professionnelles (notamment par la présence d’institutions européennes et internationales). Par ailleurs, les résidents belges séjournent également fréquemment à l’étranger. En 2012[2], on répertoriait 7.8 millions de voyages (> 4 nuits) de résidents belges à l’étranger: 6.5 millions de voyages dans un pays européen et 1.3 million hors Europe (Tableau 1).
3.3.2. Les flux migratoires en Belgique
Les flux migratoires jouent sans doute également un rôle dans la globalisation de la problématique de la résistance aux antibiotiques et dans la diffusion des MDRO entre les continents et les pays(12).
En 2012, 10.6% de la population belge était de nationalité étrangère[3] (versus 8.4% en 2001). Les principaux pays d’origine des habitants belges de nationalité étrangère étaient: l’Italie (13.7%), la France (12.8%), les Pays-Bas (12.1%) et le Maroc (7.4%). Ces pays représentent à eux quatre la moitié de la population belge d’origine étrangère. Les autres pays dont sont originaires les expatriés vivant en Belgique sont la Pologne (4.8%), l’Espagne (4.4%), la Roumanie (3.6%), l’Allemagne (3.4%), la Turquie (3.4%) et le Portugal (3.1%). Au cours de la dernière décennie le plus grand afflux d’immigration en Belgique est venu de Pologne (septuplé) et de Roumanie (décuplé).
A l’instar de l’Italie et de la Grèce, la Pologne a connu des épidémies importantes à CPE, principalement de type KPC, vraisemblablement importées à partir des États-Unis(13).
Ces migrants de nationalité étrangère conservent souvent des contacts et attaches familiales dans leur pays d’origine, contribuant ainsi au risque accru de diffusion transfrontalière des CPE ainsi que d’autres MDRO.
Dans notre pays, les concentrations les plus élevées de citoyens de nationalité étrangère sont situées dans quelques communes de l’agglomération bruxelloise et dans la périphérie de Bruxelles, dans les autres grandes villes (Anvers, Liège, Charleroi), dans les régions frontalières, les villes universitaires et autour de l’ancien axe industriel de la Wallonie.
3.3.3. Les rapatriements sanitaires à partir de l’étranger vers un hôpital en Belgique
En Belgique, les rapatriements sanitaires de patients avec des pathologies complexes ou des traumatismes, à partir d’un hôpital à l’étranger vers un hôpital belge sont assurés par diverses organisations nationales/internationales (e.a. les mutualités, les assureurs de voyage). Ceci explique la difficulté de quantifier globalement le nombre et les caractéristiques des patients rapatriés en Belgique. MUTAS[4], une de ces organisations, rapportait en 2013 649 cas de rapatriements sanitaires d’urgence de l’étranger vers un hôpital belge, dont 81% à partir d’un pays européen, 12% de l’Afrique et 7% de l’Asie (Tableau 1).
Le dépistage du portage de germes multi-résistants (dont les CPE) chez les patients directement rapatriés d’un hôpital à l’étranger vers un hôpital belge pourrait en théorie être effectué relativement facilement si des procédures standard étaient instaurées systématiquement par les organisations internationales assurant les rapatriements sanitaires.
Il semble par contre beaucoup plus difficile de cibler les patients ayant voyagé à l’étranger mais qui retournent à leur domicile avant d’être admis dans un hôpital belge. A l’évidence, il paraît encore beaucoup plus ardu de repérer des personnes ayant seulement effectué un voyage dans des pays endémiques (p.ex. : l’Inde), sans aucune exposition à d’autres facteurs de risque (soins de santé). La récolte des données d’anamnèse relatives à un séjour ou à des soins (dans l’année antérieure) dans un pays étranger s’avère de plus en plus incontournable mais reste cependant très difficile à réaliser dans la pratique quotidienne. Une telle stratégie est cependant appliquée avec succès aux Pays-Bas depuis plusieurs décennies pour la maîtrise des MRSA (methicillin resistant Staphylococcus aureus) et ceci devrait nous inciter à l’intégrer de manière systématique dans les pratiques médicales lors de l’admission à l’hôpital. Les praticiens de première ligne, notamment les médecins généralistes et les équipes de soins à domicile devraient également être informés de l’existence et de l’importance des CPE (associées au voyage) car ce mécanisme de résistance est actuellement encore trop peu connu et est souvent considéré à tort comme une problématique exclusivement hospitalière.
3.3.4. Les soins médicaux programmés chez des patients étrangers en Belgique
La qualité et l’accessibilité des soins médicaux en Belgique est excellente. Le phénomène des patients étrangers qui viennent se faire soigner (soins médicaux programmés) en Belgique n’est pas neuf. Par manque de moyens dans certains pays ou à cause d’une limitation d’accès aux soins, et de l’existence de longues listes d’attente[5]–[6], le recours par des patients étrangers à des soins en Belgique est en augmentation constante depuis plusieurs années.
Entre 2004 et 2008[7], le nombre de patients étrangers, résidant hors de Belgique, hospitalisés dans un hôpital belge a progressé de 60%.
En 2010, 1.5% des hospitalisations classiques dans les hôpitaux belges concernaient des patients étrangers, résidant hors de Belgique. Des contrats avec des prestataires ou avec des établissements de soins pour la prise en charge de ces patients sont de plus en plus fréquemment souscrits. En 2010, 29 hôpitaux belges avaient au total 83 contrats de soins pour des patients étrangers (e.a. pour le traitement du cancer ou pour une chirurgie cardio-vasculaire, esthétique ou orthopédique,…)
La majorité des patients étrangers utilisateurs de soins médicaux programmés en Belgique proviennent des Pays-Bas (58.4%), de la France (19.8%), du Grand-duché du Luxembourg (4.5%), de l’Italie (2.9%) et de la Grande-Bretagne (2.8%). Les arrondissements d’Anvers, Gand, Bruges et Hasselt ainsi que Bruxelles-Capitale comptent le plus de séjours hospitaliers de non-résidents.
Ces patients peuvent importer des entérobactéries BLSE et/ou CPE-positifs voire d’autres MDRO (entérocoques résistants à la vancomycine, MRSA, Acinetobacter baumannii,…) dans nos hôpitaux, tout comme ils peuvent ensuite exporter les MDRO circulant dans notre pays vers leur pays d’origine, ce qui contribue à la globalisation des MDRO.
3.3.5. Les résidents dans les maisons de repos situées dans les zones frontalières
Les résidents des maisons de repos et de soins (MRS) pour personnes âgées (cf. en France les établissements d’hébergement pour personnes âgées dépendantes) constituent une autre source potentielle de diffusion des MDRO, notamment par le biais des établissements situés dans les zones frontalières. En 2004, une maison de repos située à la frontière franco-belge a été clairement impliquée dans l’importation à partir de la France (en situation épidémique) d’Acinetobacter baumannii producteur de BLSE (type VEB-1) dans plusieurs hôpitaux belges[8]. Une proportion importante (+/- 60%) des personnes qui résident dans ces MRS localisées à la frontière franco-belge est de nationalité française et peut être hospitalisée soit en France soit en Belgique, assurant ainsi la propagation de bactéries multi-résistantes d’un pays à l’autre. Dans ces établissements de soins, les personnes colonisées par des CPE (mais aussi par des EBLSE) sont le plus souvent colonisés (portage asymptomatique au niveau de la flore intestinale), parfois pendant des périodes prolongées (de 1 à plusieurs mois). Les contacts de la vie quotidienne (toilettes, soins rapprochés, activités de rééducation,…) constituent des opportunités de transmission des MDRO de ces personnes vers le personnel soignant ou vers leur entourage proche. L’impact clinique du portage de MDRO (dont les CPE) pour ces personnes saines est sans doute très limité mais le risque de constitution de réservoirs en MRS ou de vecteur de transmission dans la communauté est cependant réel.
3.3.6. Le personnel soignant ayant séjourné à l’étranger comme source potentielle de contamination de patients
Bien qu’il n’existe que très peu de données quant à l’importance du personnel soignant en tant que source ou réservoir de contamination de patients hospitalisés ou institutionnalisés en établissement de soins chroniques, des cas de transmission de CPE à des patients à partir de membres du personnel de soins ayant eux-mêmes séjourné à l’étranger ont été rapportés occasionnellement(14). La libre circulation de services et de personnes au sein de l’Union européenne est responsable de l’accroissement du nombre de professionnels de la santé étrangers qui travaillent dans nos établissements de soins en Belgique. Il est probable que cette catégorie de la population conserve des attaches familiales et voyage dès lors plus fréquemment vers son pays d’origine.
Le dépistage du personnel médical et paramédical n’est pas recommandé actuellement en cas de cas sporadiques ou groupés, mais cette mesure peut éventuellement s’avérer utile dans des situations spécifiques lorsqu’une épidémie ne peut être maîtrisée malgré l’application stricte des mesures de prévention et de contrôle de la transmission.
Tableau 1: Chiffres relatifs au nombre de voyages à l’étranger, nombre de rapatriements sanitaires et nombre de soins médicaux planifiés pour patients étrangers et pourcentage de la population immigrée en Belgique
[1] Avis du Conseil Supérieur de la Santé nr. 8791 (7 décembre 2011): Mesures à prendre suite à l’émergence des entérobactéries productrices
de carbapénémases (CPE) en Belgique.
[2]Service Public Fédéral Economie: Enquête voyages, données 2012.
[3] Service Public Fédéral Economie, Direction Générale du Statistique et information économique: Aperçu statistique de la Belgique: chiffres clés 2013.
[4] MUTAS: projet intermutualiste pour soins médicaux d’urgence en Belgique.
[5] Observatoire de la mobilité des patients: Rapport annuel 2012 (INAMI et SPF Santé Publique)
[6] Soins Programmés à des patients étrangers: Impact sur le système Belge de Soins de Santé: KCE reports 169B.
[7] Données Résumé Clinique Minimum: 2004-2008.
[8] Enquête épidémiologique relative à Acinetobacter baumannii producteur de BLSE (type VEB-1) en Belgique. IPH/EPI-reports: Nr. 2004 – 18. (http://www.nsih.be/download/acinetobacter/acinetobacter.pdf)
3.4. Le risque de dissémination de CPE (associé au voyage)
3.4.1. La Belgique, un pays à forte densité de population
Outre les différents risques potentiels d’importation de CPE en Belgique déjà cités, il existe aussi un risque potentiel de dissémination de CPE et d’autres MDRO lié à la densité tant de la population que des différents réseaux et structures de soins de santé qui caractérisent notre pays. En effet, la densité de la population en Belgique est parmi les plus élevées d’Europe (367 habitants par km2, Figure 7). En ce, notre pays est seulement précédé par Malte (1327/km2) et par les Pays-Bas (497/km2).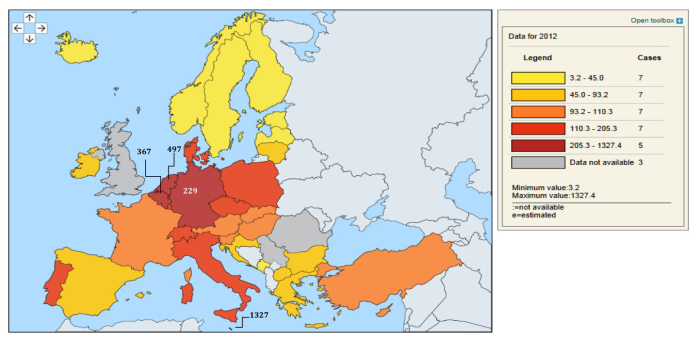
Figure 7: Densité de la population en Europe (source: Eurostat, population density, data 2012)
Cependant, la densité de la population en Belgique varie fortement selon les provinces et selon les régions (Figure 8) : ainsi, elle est deux fois plus élevée en Flandre qu’en Wallonie. La densité de population la plus élevée s’observe dans la région de Bruxelles-Capitale (7249 habitants/km2), suivi par les provinces d’Anvers (643), du Brabant flamand (523) et de Flandre orientale (496).
Dans les provinces du Luxembourg (62/km2), de Namur (133) et de Liège (284) la densité de la population est la plus basse.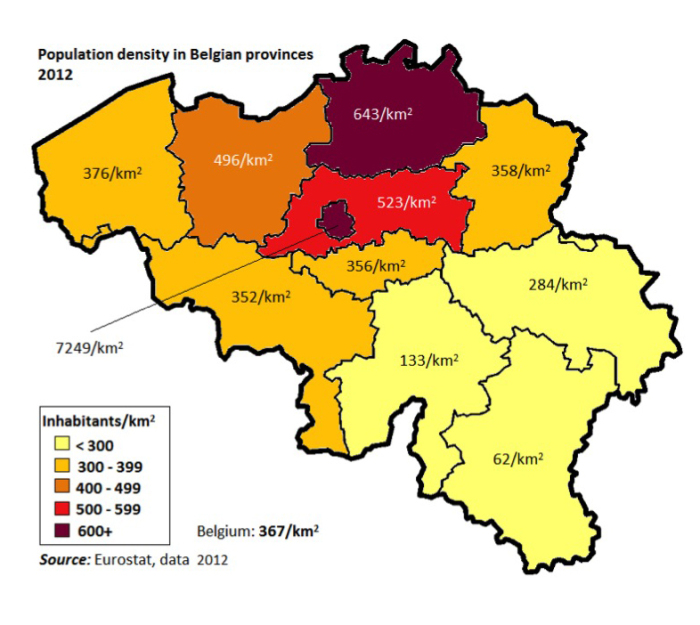
Figure 8: Densité de la population dans les provinces belges (Source: Eurostat, population density by region NUTS 2, data 2012)
Plusieurs publications suggèrent que la densité de la population (et la surpopulation) pourrait influencer la prévalence de l’antibiorésistance(15)–(16). La densité de la population influencerait le nombre de bactéries résistantes circulant dans la communauté et augmenterait le risque de transmission croisée entre les humains vivant dans la promiscuité. Certaines zones urbaines (grandes villes) cumulent les différentes sources potentielles d’importation de CPE: densité de population élevée, réseau d’établissements de soins dense, concentration d’hôpitaux universitaires, proportion de population étrangère plus importante, tourisme plus important.
En 2012-2013, un tiers des cas de CPE déclarés en Belgique n’avait apparemment eu aucun contact avec des soins de santé (hôpital aigu, MRS) dans les 12 mois qui avaient précédé la détection de CPE. Même s’il est probable (tout comme pour le voyage et l’hospitalisation lors d’un séjour à l’étranger) que la notion de contact préalable avec une institution de soins soit sous-évaluée, ceci suggère néanmoins que les CPE pourraient probablement avoir déjà largement diffusé dans la communauté en Belgique. Des études sont cependant nécessaires afin de préciser l’étendue des réservoirs dans différents secteurs de soins de santé et dans différents groupes de population dans la communauté.
4.- Conclusion
Le programme de surveillance active des CPE en Belgique initié en 2012 a permis d’estimer la proportion des cas de CPE liés à l’étranger dans notre pays. Le présent article souligne les limites de cette surveillance (36% de données manquantes) et passe en revue d’autres sources potentielles d’importation de CPE, liées ou non à des contacts avec les soins de santé à l’étranger.
Il semble prudent de considérer aujourd’hui comme à risque accru de portage de CPE (et d’autres MDRO) tout patient ayant reçu des soins médicaux dans un établissement à l’étranger, quel que soit le pays considéré, même si il est probable que le niveau de risque puisse être très différent selon les zones géographiques considérées.
Un groupe d’experts mandaté par le Conseil Supérieur de la Santé travaille actuellement à la mise à jour des recommandations en matière de prévention et de maîtrise de la transmission des CPE dans les établissements de soins en Belgique.
Le 30 septembre 2013, les Ministres compétents en matière de Santé Publique de l’Etat fédéral et des Entités fédérées ont signé le protocole d’accord (Moniteur Belge du 21 novembre 2013) concernant le Plan national MDRO. Ce plan trace les contours de l’approche coordonnée future de la lutte contre la résistance microbienne dans notre pays et entend associer l’ensemble des acteurs concernés (‘stakeholders’, experts, autorités publiques, acteurs de la santé, patients et associations impliquées). Un comité technique MDRO (TC-MDRO) et une commission nationale de lutte contre les MDRO (CNL-MDRO) ont été instaurés afin de mener à bien les objectifs du plan National MDRO. Le TC-MDRO a pour missions d’évaluer les risques liés aux MDRO, d’analyser les résultats des programmes de surveillance et des études existantes, d’optimaliser ces surveillances et d’implémenter de nouvelles surveillances et études si nécessaire. La CNL-MDRO est chargée de la mise en œuvre des recommandations émises par le CT-MDRO, de la coordination, de la communication et du suivi des initiatives dans la lutte contre les MDRO en Belgique.
Le plan national MDRO a également consacré la mise sur pied d’une équipe d’intervention sur le terrain appelée ‘outbreak support team’ (OST) qui, pourrait lorsque nécessaire aider les établissements affectés dans la gestion et le contrôle des épidémies impliquant des MDRO. Outre les médecins inspecteurs de communautés (les équipes luttant contre les foyers épidémiques des entités fédérales), les autres partenaires associés de l’OST sont l’équipe d’hygiène hospitalière, la direction de l’hôpital, le WIV-ISP, le délégué du Centre National de Référence concerné et si nécessaire un groupe d’experts externes.
Des évaluations régulières devront être réalisées afin d’évaluer l’efficacité des mesures et actions visant à endiguer ou à limiter l’impact des MDRO dans les institutions de soins de notre pays.
Références
(1) Ruppe E, Armand-Lefevre L, Estellat C, El-Mniai A, Boussadia Y, Consigny PH, et al. Acquisition of carbapenemase-producing Enterobacteriaceae by healthy travellers to India, France, February 2012 to March 2013. Euro Surveill 2014;19(14).
(2) Murray BE, Mathewson JJ, DuPont HL, Ericsson CD, Reves RR. Emergence of resistant fecal Escherichia coli in travelers not taking prophylactic antimicrobial agents. Antimicrob Agents Chemother 1990 Apr;34(4):515-8.
(3) Laupland KB, Church DL, Vidakovich J, Mucenski M, Pitout JD. Community-onset extended-spectrum beta-lactamase (ESBL) producing Escherichia coli: importance of international travel. J Infect 2008 Dec;57(6):441-8.
(4) Tangden T, Cars O, Melhus A, Lowdin E. Foreign travel is a major risk factor for colonization with Escherichia coli producing CTX-M-type extended-spectrum beta-lactamases: a prospective study with Swedish volunteers. Antimicrob Agents Chemother 2010 Sep;54(9):3564-8.
(5) Ostholm-Balkhed A, Tarnberg M, Nilsson M, Nilsson LE, Hanberger H, Hallgren A. Travel-associated faecal colonization with ESBL-producing Enterobacteriaceae: incidence and risk factors. J Antimicrob Chemother 2013 Sep;68(9):2144-53.
(6) Paltansing S, Vlot JA, Kraakman ME, Mesman R, Bruijning ML, Bernards AT, et al. Extended-spectrum beta-lactamase-producing enterobacteriaceae among travelers from the Netherlands. Emerg Infect Dis 2013 Aug;19(8):1206-13.
(7) Tham J, Odenholt I, Walder M, Brolund A, Ahl J, Melander E. Extended-spectrum beta-lactamase-producing Escherichia coli in patients with travellers’ diarrhoea. Scand J Infect Dis 2010 Apr;42(4):275-80.
(8) Arcilla MS, van Hattem JM, Bootsma MC, van Genderen PJ, Goorhuis A, Schultsz C, et al. The Carriage Of Multiresistant Bacteria After Travel (COMBAT) prospective cohort study: methodology and design. BMC Public Health 2014;14:410.
(9) Freeman JT, McBride SJ, Heffernan H, Bathgate T, Pope C, Ellis-Pegler RB. Community-onset genitourinary tract infection due to CTX-M-15-Producing Escherichia coli among travelers to the Indian subcontinent in New Zealand. Clin Infect Dis 2008 Sep 1;47(5):689-92.
(10) Ahmed-Bentley J, Chandran AU, Joffe AM, French D, Peirano G, Pitout JD. Gram-negative bacteria that produce carbapenemases causing death attributed to recent foreign hospitalization. Antimicrob Agents Chemother 2013 Jul;57(7):3085-91.
(11) van der Bij AK, Pitout JD. The role of international travel in the worldwide spread of multiresistant Enterobacteriaceae. J Antimicrob Chemother 2012 Sep;67(9):2090-100.
(12) MacPherson DW, Gushulak BD, Baine WB, Bala S, Gubbins PO, Holtom P, et al. Population mobility, globalization, and antimicrobial drug resistance. Emerg Infect Dis 2009 Nov;15(11):1727-32.
(13) Baraniak A, Grabowska A, Izdebski R, Fiett J, Herda M, Bojarska K, et al. Molecular characteristics of KPC-producing Enterobacteriaceae at the early stage of their dissemination in Poland, 2008-2009. Antimicrob Agents Chemother 2011 Dec;55(12):5493-9.
(14) Perez F, Van DD. Carbapenem-resistant Enterobacteriaceae: a menace to our most vulnerable patients. Cleve Clin J Med 2013 Apr;80(4):225-33.
(15) Bruinsma N, Hutchinson JM, van den Bogaard AE, Giamarellou H, Degener J, Stobberingh EE. Influence of population density on antibiotic resistance. J Antimicrob Chemother 2003 Feb;51(2):385-90.
(16) MacDougall C, Powell JP, Johnson CK, Edmond MB, Polk RE. Hospital and community fluoroquinolone use and resistance in Staphylococcus aureus and Escherichia coli in 17 US hospitals. Clin Infect Dis 2005 Aug 15;41(4):435-40.
Nouveautés
Agenda scientifique
- mars 2024
-
28/03
Symposium BICS
- avril 2024
-
du 8/04 au 11/04 || à Edinburgh
The Microbiology Society Annual Conference
-
du 23/04 au 24/04 || à Birmingham
Prévention et Contrôle des infections (IPC)
-
du 27/04 au 30/04 || à Barcelone
34th European Congress of Clinical Microbiology and infectious diseases
- mai 2024
-
du 16/05 au 17/05 || à Louvain-La-Neuve
18ème Rencontre Internationale Francophone des Infirmiers et Infirmières (RIF)


